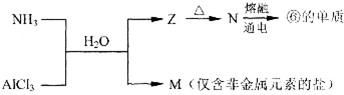
题目内容
11.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g).下列说法正确的是( )| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率,对逆反应速率无影响 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
分析 根据温度和催化剂对化学反应速率的影响以及利用化学平衡状态的特征”等“和”定“来分析解答此题.
解答 解:A.升高温度正逆反应的速率都增加,故A错误;
B、反应达到平衡后,正、逆反应速率相等且保持恒定,故B正确;
C、使用催化剂可同等程度地提高正逆反应速率,故C错误;
D、单位时间内消耗CO和CO2的物质的量相等时,即正逆反应速率相等,反应达到平衡,故D正确;
故选BD.
点评 本题考查了化学反应速率的影响因素和化学平衡状态的判断,选项A中涉及到反应平衡和反应速率问题,不管是吸热还是放热反应,当温度升高时候,反应速率都加快,温度降低是,速率都降低,这是活化能问题,而对于平衡来说,吸热反应,当温度升高有利于反应正向进行,对放热反应来说,降温有利于正向反应,要区别开反应速率和反应平衡.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列对于加成反应的说法中正确的是( )
| A. | 加成反应的结果是使有机化合物中不再含有不饱和键 | |
| B. | 福尔马林可以作为食品保鲜剂 | |
| C. | 甲苯在光照条件下与氯气反应,主要生成2,4-二氯甲苯 | |
| D. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量相等 |
2.下列说法正确的是( )
| A. | 常温下,0.1 mol/L的下列溶液①NH4Al(SO4)2;②NH4Cl;③NH3•H2O;④CH3COONH4⑤(NH4)2SO4中,c(NH4+)由大到小的顺序是:⑤>②>①>④>③ | |
| B. | 常温下,0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 常温下,将CH3COONa、HCl两溶液混合后,溶液呈中性,溶液中c(Na+)大于c(Cl-) | |
| D. | pH相等的下列溶液:a.CH3COOK、b.NaHCO3、c.Na2CO3、d.NaOH,其物质的量浓度由小到大顺序为:d<c<a<b |
16.下列各项中表达正确的是( )
| A. | N2的结构式::N≡N: | B. | F-离子结构示意图: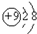 | ||
| C. | 用电子式表示HCl形成过程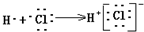 | D. | 次氯酸电子式 |
3.某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体.在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5的描述中正确的是( )
| A. | NH5由分子构成 | B. | NH5属于离子化合物 | ||
| C. | NH5中N的化合价为-5价 | D. | NH5与水的反应是非氧化还原反应 |
1. (Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如图所示,分析判断:EF段化学反应速率最快.
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是ACD
A.加入蒸馏水
B.加入浓盐酸
C.加入氯化钠溶液
D.降低反应体系的温度
(Ⅱ)以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,不同时间点测得密闭体系中三种物质的物质的量浓度:
素材2:反应在不同条件下进行时SO2的转化率:
根据以上的两个素材回答问题:
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.015mol/(L•s).
(2)根据素材2中分析得到,提高该化学反应限度的途径有降低温度、增大压强.
(3)若不考虑化学反应速率因素,仅根据素材2中分析,你认为硫酸厂能够取得最大经济效益需控制的反应条件是400℃、0.1MPa.
 (Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:(1)实验过程如图所示,分析判断:EF段化学反应速率最快.
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是ACD
A.加入蒸馏水
B.加入浓盐酸
C.加入氯化钠溶液
D.降低反应体系的温度
(Ⅱ)以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,不同时间点测得密闭体系中三种物质的物质的量浓度:
| 时间(s) 物质的量浓度(mol/L) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.015mol/(L•s).
(2)根据素材2中分析得到,提高该化学反应限度的途径有降低温度、增大压强.
(3)若不考虑化学反应速率因素,仅根据素材2中分析,你认为硫酸厂能够取得最大经济效益需控制的反应条件是400℃、0.1MPa.


 .
.
 .
.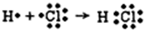 .
.