题目内容
12.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,B原子最外层中有两个未成对的电子,D、E原子核内各自的质子数与中子数相等,B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1.根据以上条件,回答下列问题:(1)推断五种元素(写化学式)分别是
AC,BO,CN,DSi,ES.
(2)B原子的电子排布式1s22s22p4C原子的价电子排布式2s22p3D原子的价电子排布式3s23p2E原子的电子排布式1s22s22p63s23p4
(3)指出A元素在元素周期表中的位置第二周期ⅣA族.
(4)比较A、B、C三种元素的第一电离能的大小顺序N>O>C(由大到小的顺序排列).
(5)比较元素D和E的电负性的相对大小S>Si.
分析 A原子最外层p能级的电子数等于次外层的电子数总数,p能级电子数不超过6,原子只能有2个电子层,则A的核外电子排布为1s22s22p2,故A为C元素;A、B、C属于同一周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,则B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物,在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,故M(D)=28,则D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,据此解答.
解答 解:A原子最外层p能级的电子数等于次外层的电子数总数,p能级电子数不超过6,原子只能有2个电子层,则A的核外电子排布为1s22s22p2,故A为C元素;A、B、C属于同一周期,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,则B为O元素,B元素可分别与A、C、D、E生成RB2型化合物,则C为N元素,可形成NO2化合物,在DB2中D与B的质量比为7:8,则有M(D):2M(O)=7:8,故M(D)=28,则D为Si元素;在EB2中E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素.
(1)由上述分析可知,A为C元素,B为O元素,C为N元素,D为Si,E为S元素,故答案为:C;O;N;Si;S;
(2)B为O元素,原子的电子排布式为1s22s22p4,C为N元素,原子的价电子排布式为2s22p3,D为Si元素,原子的价电子排布式为3s23p2,E为S元素,原子的电子排布式为1s22s22p63s23p4,
故答案为:1s22s22p4;2s22p3;3s23p2;1s22s22p63s23p4;
(3)A为C元素,在元素周期表中的位置:第二周期ⅣA族,故答案为:第二周期ⅣA族;
(4)同周期元素的第一电离能随着原子序数的增大而呈增大趋势,但N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于同周期相邻元素,所以这三种元素的第一电离能从大到小顺序是:N>O>C,故答案为:N>O>C;
(5)同周期随原子序数增大,电负性增大,故电负性:S>Si,故答案为:S>Si.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语与元素周期律的考查,注意理解掌握同周期第一电离能异常原因.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 常温下,0.1 mol/L的下列溶液①NH4Al(SO4)2;②NH4Cl;③NH3•H2O;④CH3COONH4⑤(NH4)2SO4中,c(NH4+)由大到小的顺序是:⑤>②>①>④>③ | |
| B. | 常温下,0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 常温下,将CH3COONa、HCl两溶液混合后,溶液呈中性,溶液中c(Na+)大于c(Cl-) | |
| D. | pH相等的下列溶液:a.CH3COOK、b.NaHCO3、c.Na2CO3、d.NaOH,其物质的量浓度由小到大顺序为:d<c<a<b |
| A. | NH5由分子构成 | B. | NH5属于离子化合物 | ||
| C. | NH5中N的化合价为-5价 | D. | NH5与水的反应是非氧化还原反应 |
| 元素代号 | L | M | Q | R | T |
| 原子半径/mm | 0.160 | 0.089 | 0.143 | 0.102 | 0.074 |
| 化合价 | +2 | +2 | +3 | +6,-2 | -2 |
| A. | L、M的单质与稀盐酸反应速率L<M | |
| B. | Q、T两元素间可形成两性化合物 | |
| C. | R、T两元素的氢化物分子间能形成氢键 | |
| D. | L、R两元素的简单离子的核外电子数可能相等 |
| A. | 0.1mol•L-1Fe(NO3)2溶液:Mg2+、H+、SO${\;}_{4}^{2-}$、Cl- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$、Na+ | |
| C. | Na2O2溶于水产生O2:2O22-+2H2O═O2↑+4OH- | |
| D. | 用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
| A. | 达到化学平衡时,N2、H2和NH3的物质的量之比为1:3:2 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| C. | 达到化学平衡时,N2不能完全转化为NH3 | |
| D. | 达到化学平衡时,容器中气体的总压强不再发生变化 |
 (Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:(1)实验过程如图所示,分析判断:EF段化学反应速率最快.
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是ACD
A.加入蒸馏水
B.加入浓盐酸
C.加入氯化钠溶液
D.降低反应体系的温度
(Ⅱ)以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,不同时间点测得密闭体系中三种物质的物质的量浓度:
| 时间(s) 物质的量浓度(mol/L) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.015mol/(L•s).
(2)根据素材2中分析得到,提高该化学反应限度的途径有降低温度、增大压强.
(3)若不考虑化学反应速率因素,仅根据素材2中分析,你认为硫酸厂能够取得最大经济效益需控制的反应条件是400℃、0.1MPa.

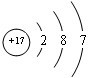 .
.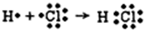 .
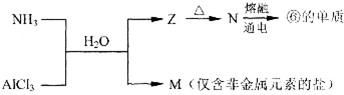
.

 .
.