题目内容
15.铜在工农业生产中有着广泛的用途.(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是Cu2++2H2O?Cu(OH)2+2H+(只写离子方程式).
(2)某同学利用制得的CuSO4溶液,进行以下实验探究.
①图甲是根据反应Fe+CuSO4═Cu+FeSO4设计的原电池,请根据图甲填空,A、B分别是什么物质:
AFe;BCuSO4溶液(填化学式).
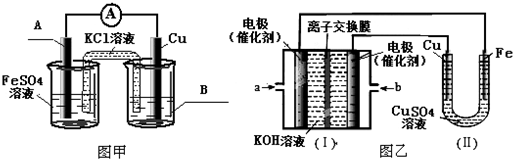
②图乙中,Ⅰ是甲烷燃料电池的示意图,该同学想在Ⅱ中实现铁上镀铜,则应在a处通入CH4(填“CH4”或“O2”),b处电极上发生的电极反应式为O2+4e-+2H2O=4OH-;若把Ⅱ中电极均换为惰性电极,电解液换为含有0.1mol NaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH=13(假设溶液体积变化忽略不计).
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2•L-2,Ksp(CuS)=1.3×10-36mol2•L-2].请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,存在溶解平衡:FeS(s)?Fe2+(aq)+S2-(aq),其中的Cu2+与S2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+ (用平衡移动原理解释).
分析 (1)CuSO4溶液中铜离子能够水解生成沉淀;
(2)①铁铜原电池中Fe为负极;②铁上镀铜,铜作阳极,铁作阴极;②a为甲烷,b为氧气,据电解质溶液显碱性书写电极反应式;阳极产生的气体为氯气,其体积为448mL(标准状况下),据此计算生成NaOH的物质的量,计算pH;
(3)沉淀转移的方向是向着更难溶的方向移动,通过Ksp的大小可知那种物质更加难溶.
解答 解:(1)CuSO4溶液中铜离子能够水解生成沉淀,加入硫酸是抑制铜离子水解,离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,故答案为:Cu2++2H2O?Cu(OH)2+2H+;
(2)①铁铜原电池中Fe为负极,据图中左池电解质溶液确定,左侧金属为Fe,右侧电解质溶液为CuSO4溶液,故答案为:Fe;CuSO4溶液;
②铁上镀铜,则Cu为阳极,Cu电极与b相连,b为原电池的正极,a为负极,a处通入CH4,即b处通入O2,b处电极上发生的电极反应式是:O2+4e-+2H2O=4OH-,
n(Cl2)=448÷22400=0.02(mol)
由:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH
1 2
电解产生n(OH-)=0.02mol×2=0.04mol
c(OH-)=0.04mol÷(400 mL/1000mL•L-1)=0.1mol•L-1
p(OH)=-lg0.1=1 pH=14-1=13,故答案为:CH4;O2+4e-+2H2O=4OH-;13;
(3)由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,故离子方程式为FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq),故答案为:存在溶解平衡:FeS(s)?Fe2+(aq)+S2-(aq),其中的Cu2+与S2-生成了溶度积更小的CuS沉淀,使得上述溶解平衡继续向右移动.
点评 本题考查了盐类水解、电解计算、沉淀转化关系的分析等,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 淀粉和纤维素 | B. | 淀粉和葡萄糖 | C. | 蔗糖和麦芽糖 | D. | 果糖和蔗糖 |
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3
④2S(g)═S2(g)△H4
则△H4的正确表达式为$\frac{2}{3}$(△H1+△H2-3△H3).
(2)某可逆反应:X(g)+3Y(g)?2Z(g)平衡常数与温度关系如表所示:
| 温度/℃ | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |
②为了增大X的转化率和反应速率,宜采用的措施是B.
A.升高温度 B.增大压强 C.加催化剂 D.分离Z
③在2L密闭容器中充入Z气体,在一定条件下进行反应.下列图1象不能表明该反应达到平衡状态的是A.

④440℃时,在2L密闭容器中,开始充入1mol X气体和3mol Y气体进行反应.在某时刻测得c(X)=0.45mol/L,此时,反应是否达到平衡状态否(填“是”或“否”),简述理由:此时浓度商Q=$\frac{{c}^{2}(Z)}{c(X){c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.45×1.3{5}^{3}}$=0.0090<K,平衡正向进行.
⑤在某容积固定的容器中进行上述反应,当X、Y起始物质的量一定时,仅改变一个外界条件对Z体积分数的影响如图2所示(曲线I为标准):
ⅰ曲线Ⅱ改变的条件是升温.
ⅱ曲线Ⅲ改变的条件是加合适的催化剂.
| A. | 打开盛装NO的集气瓶;冷却NO2气体 | |
| B. | 用冰水混合物冷却SO3气体;加热氯化铵晶体 | |
| C. | 木炭吸附NO2气体;将氯气通入品红溶液中 | |
| D. | 向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
| A. | 放电时正极材料是磷酸亚铁锂(LiFePO4) | |
| B. | 放电时正极反应为:FePO4+Li++e-═LiFePO4 | |
| C. | 充电时Li+和Fe2+向阴极移动,PO43ˉ向阳极移动 | |
| D. | 充电时阴极反应为:Li++e-═Li |
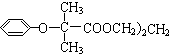
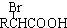 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$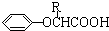
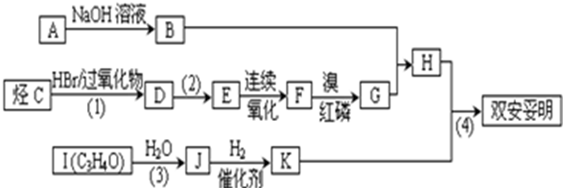
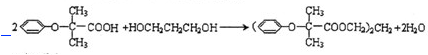
 .
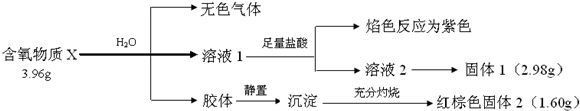
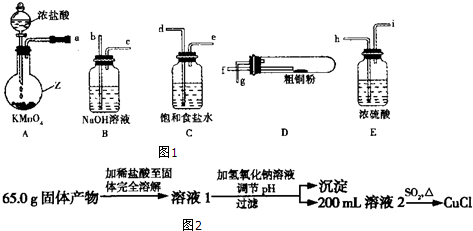
.
 元素周期表中有五种元素的性质或原子结构信息如下:
元素周期表中有五种元素的性质或原子结构信息如下: