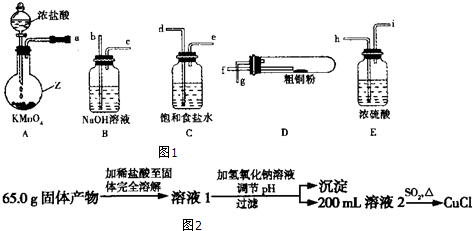
��Ŀ����
2��ʵ�������ú�����CO2���ʵ�CO����ԭ����������FexOy����֤��CO�ܹ���ԭFexOy���ұ���������ΪCO2��ʵ�����ṩ�ĸ���������ҩƷ��ͼ����1��ʵ��ʱ����������װ�õ���ȷ����˳���ǣ���д���ӿڵĴ��ţ���
��������D��C�ӣ�F������E����A��B��H��G��I��
��2����װ�����з�����Ӧ�Ļ�ѧ����ʽ��2NaOH+CO2=Na2CO3+H2O��
��3����װ�ü��з�����Ӧ�Ļ�ѧ����ʽ��FexOy+yCO$\frac{\underline{\;����\;}}{\;}$xFe+yCO2��
��4����װ���г���ʯ��ˮ�������Ǽ���CO2�Ƿ������
��5���������ⶨ��0.4g FexOy��CO��Ӧ���ɵ�����ͨ������ij���ʯ��ˮ�У�����0.75g��ɫ��������FexOy��x��y��2��3��
��6��ʵ������У���˵��CO�ܹ���ԭFexOy��ʵ�������ǹ����ĩ�Ӻ���ɫ���ɫ���ܹ�˵��CO��������CO2��ʵ�������Ƕ��г���ʯ��ˮ����ǣ�
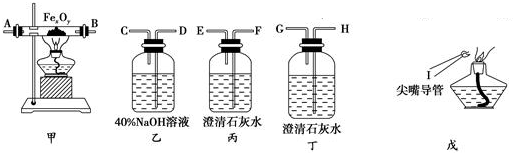
���� ��1����ʵ��Ŀ�ġ��ú�����CO2���ʵ�CO����ԭ����������FexOy����֤��CO�ܹ���ԭFexOy���ұ���������ΪCO2������ÿ��װ�õ����ã�Ȼ�����Ӹ�װ�ã�
��2��װ������ʢ�ŵ���NaOH��Һ���ܹ��������̼��Ӧ����̼���ƣ����ڳ�ȥ��������еĶ�����̼��
��3��װ�ü���CO��FexOy�ڸ����·�Ӧ���ɶ�����̼�������ݴ�д����Ӧ�Ļ�ѧ����ʽ��
��4����ʵ��Ŀ������Ҫ����CO�������������̼����ԭ��������еĶ�����̼�����ȥ������г���ʯ��ˮ����֤��������̼�Ѿ�������
��5������C�غ��ϵ�ɵã�CO��CO2��CaCO3��FexOy����������Ϊ��m��CO2��-m��CO��������̼��Ƶ����ɼ����������������Ԫ�ص����ʵ�����������Ȼ����ݸ�������������������Ԫ�ص����������������Ԫ������Ԫ�ص����ʵ���֮�ȼ��ɣ�
��6�����ݣ�5����֪����������Ϊ����ɫ����������������Ӷ�����ɫ��Ϊ��ɫʱ��֤����������CO��ԭ�������г���ʯ��ˮ�����ʱ��֤��CO�������ɶ�����̼��
��� �⣺��1��ʵ�������ú�����CO2���ʵ�CO����ԭ����������FexOy����֤��CO�ܹ���ԭFexOy���ұ���������ΪCO2��������Ҫ������������Һ��ȥ��������еĶ�����̼��Ȼ���ó���ʯ��ˮ���������̼�Ѿ���������ʼ��CO��ԭ��������������ó���ʯ��ˮ����CO�������ɶ�����̼������õ�ȼ�ķ�����ȥʣ���CO������װ������˳��Ϊ����������D��C�ӣ�F������E����A��B��H��G��I��
�ʴ�Ϊ��D��C��A��B��H��G��I��
��2��װ�����е�����������Һ�ܹ��������̼��Ӧ����̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��2NaOH+CO2=Na2CO3+H2O��
�ʴ�Ϊ��2NaOH+CO2=Na2CO3+H2O��
��3��װ�ü���FexOy��һ����̼�ڸ����·���������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ��FexOy+yCO$\frac{\underline{\;����\;}}{\;}$xFe+yCO2��
�ʴ�Ϊ��FexOy+yCO$\frac{\underline{\;����\;}}{\;}$xFe+yCO2��
��4�����г���ʯ��ˮ�ܹ�����ԭ��������еĶ�����̼�Ѿ��������Ӷ������˶Ժ���ʵ��ĸ��ţ�
�ʴ�Ϊ������CO2�Ƿ������
��5������C�غ��ϵ�ɵã�CO��CO2��CaCO3��
0.75g��ɫ����Ϊ̼��ƣ���n��CaCO3��=n��CO��=$\frac{0.75g}{100g/mol}$=7.5��10-3mol��
��FexOy����Ԫ�ص�����Ϊ��m��CO2��-m��CO��=44 g•mol-1��7.5��10-3mol-28 g•mol-1��7.5��10-3mol=0.12g��
0.4g FexOy����Ԫ�ص����ʵ���Ϊ��n��Fe��=$\frac{0.4g-0.12g}{56g/mol}$=0.005mol��
0.4g FexOy����Ԫ�ص����ʵ���Ϊ��n��O��=$\frac{0.12g}{16g/mol}$=0.0075 mol��
��$\frac{x}{y}$=$\frac{0.005mol}{0.0075mol}$=$\frac{2}{3}$��
�ʴ�Ϊ��2��3��
��6�����ݣ�5����֪����������Ϊ����ɫ��Fe2O3��������Ӷ�����ɫ��Ϊ��ɫʱ��֤����������CO��ԭ�������г���ʯ��ˮ�����ʱ��֤��CO�������ɶ�����̼��
�ʴ�Ϊ�������ĩ�Ӻ���ɫ���ɫ�����г���ʯ��ˮ����ǣ�
���� ���⿼���������仯��������ʵ�飬��Ŀ�Ѷ��еȣ�����֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ���ѧ���ķ�����������������ѧʵ��������ע�����������仯�������ʣ���ȷʵ��Ŀ��Ϊ���ؼ���ע�⻯ѧʵ���������������ʵ��װ�õ�����˳��

 ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д�| A�� | �γ��ĶԹ��õ��Ӷ� | B�� | ͨ���Ǽ��Լ� | ||
| C�� | ͨ���������ۼ� | D�� | ͨ�����Ӽ����ۼ� |
| A�� | ����¶����շ����������Ϸ����� | |
| B�� | ���øߴ����ʹ��Ƴ�̫���ܵ�� | |
| C�� | ��������ͼ�������ֲ��ոѡ���������Ƴ����� | |
| D�� | ���ö�����̼��ԭ�Ϻϳɾ�̼������ɽ������ϴ������ϩ���� |

| A�� | ������NaOH��Һ��Ӧ��ÿmol����NaOH�����ʵ���֮��Ϊ1��1 | |
| B�� | ��������ˮ��Ӧ��ÿmol����Br2�����ʵ���֮��Ϊ3��2 | |
| C�� | ������H2�����ӳɷ�Ӧ��ÿmol����H2�����ʵ���֮��Ϊ4��7 | |
| D�� | ������O2����������Ӧ��ÿmol����O2�����ʵ���֮��Ϊ13��15 |
| A�� | һ�������£�2 mol SO2��1 mol O2������ܱ������г�ַ�Ӧ�������еķ���������2NA | |
| B�� | 256 g S8�����к�S-S��Ϊ7NA����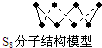 | |
| C�� | ��1 mol CH3COONa������CH3COOH�γɵ�������Һ�У�CH3COO-��ĿΪNA�� | |
| D�� | 1 mol Na��O2��ȫ��Ӧ������Na2O��Na2O2�Ļ���ת�Ƶ�������ΪNA�� |
| A�� | �������ռ���Һ��Ӧ��Cl2+OH-�TCl-+HClO | |
| B�� | Ư����Һ��ͨ��������SO2���壺Ca2++2ClO-+SO2+H2O�TCaSO3��+2HClO | |
| C�� | ������Һ������������Һ��Ӧ��ʹSO42-ǡ����ȫ������Al3++2SO42-+2Ba2++4OH-�T2BaSO4��+AlO2-+2H2O | |
| D�� | ������ͨ���Ȼ�������Һ�У�Fe2++Cl2�TFe3++2Cl- |
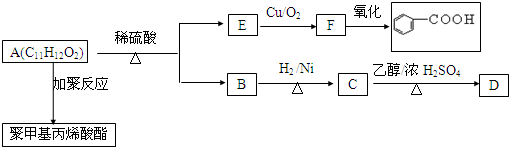
 ��
��