��Ŀ����
����Ŀ�������仯�����ڹ�ҵ�����ȷ�������Ҫ��Ӧ�á���ҵ�ϳɰ���ú������ҵ���зdz���Ҫ��һ���֣���������ʱ������(N2H4)��ȼ�ϡ�
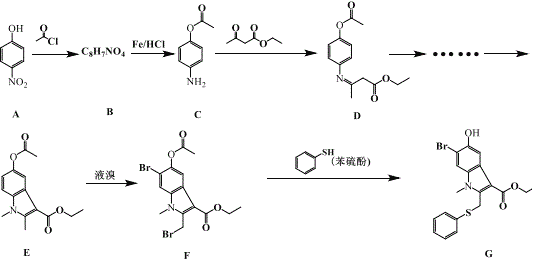
(1)��֪��17g NH3(g)��һ�������·ֽ�����N2(g)��H2(g)������46.1kJ����������ӦN2(g)+3H2(g)=2NH3(g) ��H=_______________kJ��mol-1
(2)��һ�������£����ݻ�Ϊ5L�ĺ����ܱ������г���1mol N2��3molH2��10min���������NH3Ϊ1mol������N2��ʾ��ƽ����Ӧ����Ϊ______________________��
(3)��֪��298Kʱ1g������ȼ������N2��ˮ�������ų�16.7kJ�������������Ȼ�ѧ����ʽ��д��ȷ����__________(����ĸ���)
A.N2H4+O2=N2+2H2O ��H=��534.4kJ��mol��1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) ��H=��534.4kJ��mol��1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H=��534.4kJ��mol��1
D.N2H4(g)+O2(g)= N2(g)+2H2O(g) ��H=��16.7kJ��mol��1
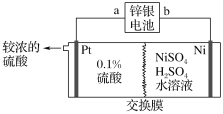
(4)N2H4��O2��KOH��Һ��ɵ�ȼ�ϵ������ˮ�͵�����
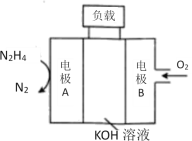
�ٸ�����ӦʽΪ_____________��
�ڷŵ�ʱ����Һ�е���������_______���ƶ�(����������������)��
�۷ŵ�ʱ����������Һ�ļ���___________(������ǿ����������������������)��
���𰸡�-92.2 0.01 mol��L-1��min-1 C N2H4��4e����4OH��= N2����4H2O �� ��ǿ
��������
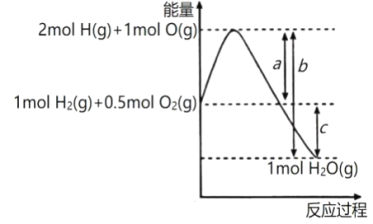
(1)����17g NH3(g)��һ�������·ֽ�����N2(g)��H2(g)������46.1kJ����������1molNH3(g)��һ�������·ֽ����յ��������ϳɰ����Ƿֽⰱ������������պͷų���������ֵ��ȣ��ݴ˼�����д��
(2)���������NH3��Ӧ���ʣ����÷�Ӧ����֮�ȵ��ڷ�Ӧ����ϵ��֮�ȣ�����N2��ƽ����Ӧ���ʣ�
(3)1g��̬����������ȼ�����ɵ�����Һ̬ˮʱ���ɷų�17kJ��������32gN2H4ȼ������CO2��Һ̬ˮʱ����17kJ��32=544kJ��1molN2H4����Ϊ32�ˣ�������ȫȼ��1molN2H4���ɵ�����Һ̬ˮ����544kJ��������д�Ȼ�ѧ����ʽע��㣬����ע������Ӧ��������״̬��s��l��g��aq�������������������������ţ���Hֻ��д�ڱ��з�Ӧ���������״̬�Ļ�ѧ����ʽ���ұߣ���Ϊ���ȷ�Ӧ����HΪ��+������Ϊ���ȷ�Ӧ����HΪ��-������H�ĵ�λһ��ΪkJ/mol��д�Ȼ�ѧ����ʽ���ݴ˼��ɽ��
(4) �¡��������������ع���ȼ�ϵ�أ�ͨ��ȼ�ϵ�һ��Ϊ������ͨ��������һ��Ϊ��������AΪ������BΪ��������������ʧ���Ӻ����������ӷ�Ӧ���ɵ�����ˮ���缫��ӦʽΪN2H4+4OH--4e-=4H2O+N2���������������õ��Ӻ�ˮ��Ӧ�������������ӣ�������ӦΪ��O2+2H2O+4e-=4OH-������ܷ�ӦΪ��N2H4+O2=N2+2H2O���ŵ�ʱԭ��������������ƶ������ݵ������Һ�ı仯��������ҺpH�ı仯��
(1)��֪��17g NH3(g)��Ϊ1mol����һ�������·ֽ�����N2(g)��H2(g)������46.1kJ����������2mol NH3(g) ��һ�������·ֽ�����N2(g)��H2(g)������46.1kJ��2mol=92.2kJ���������ϳɰ����Ƿֽⰱ��������̣����պͷų���������ֵ��ȣ��ϳɰ����Ƿ��ȷ�Ӧ����ӦN2(g)+3H2(g)2NH3(g) ��H=-92.2kJ��mol-1��
(2)��һ�������£����ݻ�Ϊ5L�ĺ����ܱ������г���1mol N2��3molH2��10min���������NH3Ϊ1mol����NH3��Ũ�ȱ仯��=![]() =0.2mol/L��10min��NH3��ƽ����Ӧ����=
=0.2mol/L��10min��NH3��ƽ����Ӧ����=![]() =0.02mol��L-1��min-1�����ݷ�ӦN2(g)+3H2(g)2NH3(g) ����Ӧ����֮�ȵ��ڷ�Ӧ����ϵ��֮�ȣ�v(N2)=
=0.02mol��L-1��min-1�����ݷ�ӦN2(g)+3H2(g)2NH3(g) ����Ӧ����֮�ȵ��ڷ�Ӧ����ϵ��֮�ȣ�v(N2)=![]() v(NH3)=
v(NH3)=![]() ��0.02mol��L-1��min-1=0.01mol��L-1��min-1��
��0.02mol��L-1��min-1=0.01mol��L-1��min-1��
(3) 1molN2H4����Ϊ32�ˣ�1g��̬����������ȼ�����ɵ�����Һ̬ˮʱ���ɷų�16.7kJ��������1molN2H4����Ϊ32�ˣ���32gN2H4ȼ�����ɵ�����Һ̬ˮʱ����16.7kJ��32=534.4kJ��������д�Ȼ�ѧ����ʽע�����ȷ�Ӧ����HΪ���������ԣ���H=534.4kJmol1��N2H4��O2��N2��H2O��Ϊ��̬�����Է�Ӧ���Ȼ�ѧ����ʽΪ��N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H=��534.4kJ��mol��1����ѡC��
(4)�ٸ��ݷ�����������ӦʽΪN2H4+4OH--4e-=4H2O+N2����
�ڷŵ�ʱΪԭ��أ�ԭ����е����������ƶ�������Һ�е����������ƶ���
�۸��ݷ����ŵ�ʱ��������ӦΪ��O2+2H2O+4e-=4OH-���������������������ӣ���Һ�ļ�����ǿ��