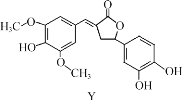
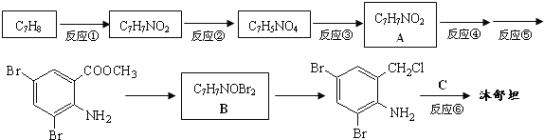
题目内容
【题目】根据下列图示所得出的结论不正确的是
A.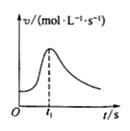 镁条与盐酸反应的化学反应速率随时间变化的曲线,说明t1时刻溶液的温度最高
镁条与盐酸反应的化学反应速率随时间变化的曲线,说明t1时刻溶液的温度最高
B.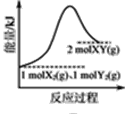 是1mol X2(g)、1mol Y2(g)反应生成2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和小于生成物所含化学键的键能总和
是1mol X2(g)、1mol Y2(g)反应生成2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和小于生成物所含化学键的键能总和
C. 是恒温密闭容器中发生CaCO3(s)CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
是恒温密闭容器中发生CaCO3(s)CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
D. 是室温下,I2+I-I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)>K(T2)
是室温下,I2+I-I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)>K(T2)
【答案】AB
【解析】
A.镁条与盐酸的反应为放热反应,开始时,反应放热,温度升高,反应速率加快,消耗的镁越多,放出的热量越多,溶液的温度越高,随着反应的进行,盐酸的浓度减小,所以t1时刻后反应速率减慢,则t1时溶液的温度不一定最高,故A错误;
B.由图象可知,1mol X2(g)、1mol Y2(g)的总能量低于2mol XY(g)的能量,反应为吸热反应,则反应物所含化学键的键能总和大于生成物所含化学键的键能总和,故B错误;
C.由图可知,t1时刻c(CO2)突然增大,一段时间后,浓度与改变前不变,则t1时刻改变的条件可能是缩小容器的体积,由于该反应平衡常数K=c(CO2),温度不变平衡常数不变,则c(CO2)减小直到与原位置一致,故C正确;
D.升高温度I3-的平衡浓度降低,平衡逆向移动,则升高温度化学平衡常数减小,温度:T1<T2,则K(T1)>K(T2),故D正确;
答案选AB。

练习册系列答案
相关题目