题目内容
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A. 以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. 其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C. 其他条件不变,若增大压强,则物质A的转化率减小
D. 达到平衡时,C的体积百分含量为0.353
【答案】AD
【解析】
试题A、生成0.6mol的C时,反应掉0.6mol的A,A的浓度变化量为0.06mol/L,除以时间10s得反应速率为0.001mol·L-1·s-,故A正确;B、当把容器的体积缩小时,容器内的压强增大,平衡会向气体系数和减小的方向移动,即向右移动,C的浓度大于原来的2倍,故B错误;C、增大压强,平衡向气体系数和减小的方向移动,即向右移动,A的转化率增大,故C错误;D、求出达到平衡时A、B、C三者的物质的量分别为0.4mol、0.7mol、0.6mol,C的体积百分含量为0.6除以1.7即0.353,故D正确;故选AD。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器 | 温度/℃ | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
Ⅱ | 758 | 0.1 | 0.05 | 0 | |
Ⅲ | 858 | 0.2 | 0.1 | 0 | |
A. 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol·L-1·s-1
B. 平衡时,容器Ⅱ中SO3的浓度小于0.022mol·L-1
C. 平衡时,容器Ⅲ中SO3的浓度大于0.044mol·L-1
D. 若起始时,向容器Ⅰ中充入0.02mol SO2、0.01mol O2和0.02mol SO3,则反应向逆反应方向进行
【题目】在2 L的密闭容器内,500℃时反应2SO2(g)+O2(g) ![]() 2SO3(g)ΔH<0体系中,n(SO2)随时间的变化如表:
2SO3(g)ΔH<0体系中,n(SO2)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________________。
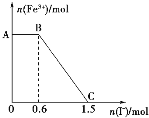
(2)下图表示SO3的变化的曲线是__________。用O2表示从0~2s内该反应的平均速率v=______________。

(3)能说明该反应已达到平衡状态的是________。
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出SO3气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(5)若在容积均为2 L的密闭容器内,500℃时按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-QkJ·mol-1(Q>0),保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
2SO3(g)ΔH=-QkJ·mol-1(Q>0),保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molSO2、 1molO2 | 2molSO3 | 4molSO2、 2molO2 |
平衡时n(SO3) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | p1 | p2 | p3 |
反应物的转化率 | α1 | α2 | α3 |
三个容器中的反应分别达平衡时下列各组数据关系正确的是____(填字母)。
A.α1+α2=1 B. Q1+Q2=Q C. α3<α1 D. p3<2p1=2p2 E. n2<n3<1.0mol F. Q3=2Q1
(6)在一定条件下进行反应2SO2(g)+O2(g) ![]() 2SO3(g),如图所示。
2SO3(g),如图所示。
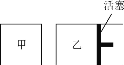
相同温度下,在甲、乙两容器中各投入2molSO2、1molO2,甲、乙两容器的初始体积均为1L,甲、乙容器达到平衡所用时间:甲____(填“>”、“<”或“=”,下同)乙,平衡时SO2的转化率:甲____乙。