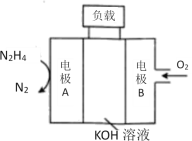
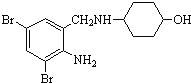
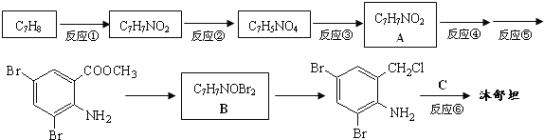
题目内容
【题目】已知:①2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H1=﹣154 kJmol﹣1
②S(s)+O2(g)═SO2(g)△H2=﹣297 kJmol﹣1
③2H2S(g)+O2(g)═2S(s)+2H2O(l)△H3
④2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H4
下列说法正确的是
A.△H3>△H4B.△H3=+143 kJmol﹣1
C.无法计算△H4的值D.H2S 燃烧热为 1045 kJmol﹣1
【答案】A
【解析】
根据盖斯定律:
①+②得到③2H2S(g)+O2(g)═2S(s)+2H2O(l)△H3=(-154 kJ·mol-1)+(-297kJ·mol-1)=-451 kJ·mol-1,
①+3×②得到④2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H4=(-154 kJ·mol-1)+3×(-297kJ·mol-1)=-1045 kJ·mol-1,即H2S(g)+![]() O2(g)=SO2(g)+H2O(l)△H=(-1045 kJ·mol-1)×
O2(g)=SO2(g)+H2O(l)△H=(-1045 kJ·mol-1)×![]() =-522.5 kJ·mol-1,
=-522.5 kJ·mol-1,
A、△H3=-451 kJ·mol-1,△H4=-1045 kJ·mol-1,所以△H3>△H4,故A正确;
B、△H3=-451 kJ·mol-1,故B错误;
C、①+3×②得到△H4=-1045 kJ·mol-1,故C错误;
D、H2S 燃烧热的热化学方程式为H2S(g)+![]() O2(g)=SO2(g)+H2O(l)△H=-522.5 kJ·mol-1,所以H2S 燃烧热为522.5kJ·mol-1,故D错误;
O2(g)=SO2(g)+H2O(l)△H=-522.5 kJ·mol-1,所以H2S 燃烧热为522.5kJ·mol-1,故D错误;
故选:A。

【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(H+) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大