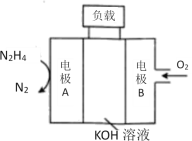
题目内容
【题目】下列条件下,对应离子一定能大量共存的是( )
A.中性溶液中:Mg2+、Fe3+、CO32-、SO42-
B.使甲基橙变红的溶液中:NH4+、Al3+、Cl-、Mg2+
C.25℃时,水电离出的c(H+)=1×10-13mol·L-1:K+、Ba2+、NO3-、S2-
D.![]() =1×1012的溶液中:Fe2+、NO3-、HCO3-、Na+
=1×1012的溶液中:Fe2+、NO3-、HCO3-、Na+
【答案】B
【解析】
A.Mg2+与CO32生成碳酸镁沉淀且Fe3+与CO32发生双水解生成氢氧化铁沉淀,所以在中性溶液中不能大量共存,故A错误;
B.甲基橙变红色的溶液呈酸性,这几种离子之间不反应且和氢离子不反应,所以能大量共存,故B正确;
C.25℃时,水电离出的c(H+)=1×10-13mol·L-1,说明水的电离被抑制,溶液呈强酸性或强碱性,强酸性条件下NO3、S2发生氧化还原反应而不能大量共存,故C错误;
D.![]() =1×1012的溶液中,c(OH)>c(H+),则溶液呈碱性,OH和Fe2+、HCO3反应而不能大量共存,故D错误;
=1×1012的溶液中,c(OH)>c(H+),则溶液呈碱性,OH和Fe2+、HCO3反应而不能大量共存,故D错误;
答案选B。

练习册系列答案
相关题目
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(H+) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的逆反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大