��Ŀ����
����Ŀ����֪��ӦH2(g)+O2(g)=H2O(g)�������仯��ͼ��ʾ��a��b��c��ʾ�����仯��Ϊ��ֵ����λΪkJ������˵����ȷ����
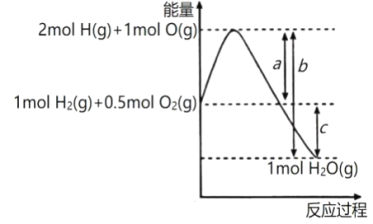
A. �γ�1 mol H2O(g)�еĻ�ѧ����Ҫ����bkJ������
B. 2H2O(g)==2H2(g)+O2(g) ��H=-2(a-b) kJmol-1
C. H2O(l)==H2(g)��O2(g) ��H��ckJ��mol��1
D. 2molH2(g)��1molO2(g)��ȫ��Ӧ����2molH2O(l)�ų�������С��2(b-a) kJ
���𰸡�B
��������A�2molH��g����1molO��g���γ�1molH2O��g���еĻ�ѧ���ͷ�bkJ��������B�����ͼʾH2��g��+1/2O2��g��=H2O��g����H=��a-b��kJ/mol��C����H2O��l����H2O��g������������D�H2O��g����H2O��l���ų�������
A�2molH��g����1molO��g���γ�1molH2O��g���еĻ�ѧ���ͷ�bkJ��������A�����B�����ͼʾH2��g��+1/2O2��g��=H2O��g����H=��a-b��kJ/mol����2H2O��g��=2H2��g��+O2��g����H=-2��a-b��kJ/mol��B����ȷ��C��������ͼʾ��H2O��g��=H2��g��+1/2O2��g����H=ckJ/mol��H2O��l����H2O��g������������H2O��l��=H2��g��+1/2O2��g����H![]() ckJ/mol��C�������D�2molH2��g����1molO2��g����ȫ��Ӧ����2molH2O��g���ų�������Ϊ2��b-a��kJ��H2O��g����H2O��l���ų�������2molH2��g����1molO2��g����ȫ��Ӧ����2molH2O��l���ų�����������2��b-a��kJ��D�����ѡB��
ckJ/mol��C�������D�2molH2��g����1molO2��g����ȫ��Ӧ����2molH2O��g���ų�������Ϊ2��b-a��kJ��H2O��g����H2O��l���ų�������2molH2��g����1molO2��g����ȫ��Ӧ����2molH2O��l���ų�����������2��b-a��kJ��D�����ѡB��

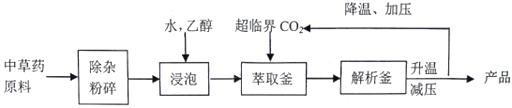
 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�