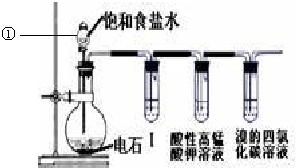
题目内容
16.如图,有关零排放车载燃料电池叙述正确的是( )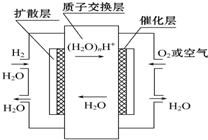
| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 导电离子为质子,且在电池内部由正极定向移向负极 | |
| D. | 总反应式为2H2+O2=2H2O |
分析 氢氧燃料电池中,通入燃料氢气的电极是负极,发生氧化反应、通入氧化剂氧气的电极是正极发生还原反应,阳离子移向正极,阴离子移向负极,总反应即燃料燃烧反应,据此分析解答.
解答 解:A.燃料电池中,负极上通入燃料、正极上通入氧化剂,所以正极通入氧气,发生还原反应,故A错误;
B.燃料电池中,负极上通入燃料,所以负极通入H2,发生氧化反应,故B错误;
C.导电离子为质子.质子带正电荷,应由负极移向正极,故C错误;
D.总反应即燃料燃烧反应即2H2+O2=2H2O,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高考高频点,明确原电池原理是解本题关键,所有燃料电池中都是负极上通入燃料、正极上通入氧化剂,会根据溶液酸碱性书写电极反应式.

练习册系列答案
相关题目
15.如图为元素周期表短周期的一部分.其中W元素的最高正价与最低负价的代数和为4.下列有关说法正确的是( )
| X | |||
| Z | Y | W |
| A. | X、Y、W的氧化物都属于酸性氧化物 | |
| B. | 工业上采用电解Z的氯化物制备Z单质 | |
| C. | W的单质易溶于XW2 | |
| D. | 1molX或Y的最高价氧化物分子中都含有2mol双键 |
7.下列图示中,表示反应是吸热反应的是( )
| A. | 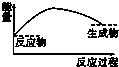 | B. | 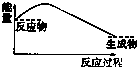 | C. | 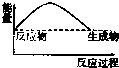 | D. | 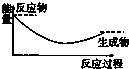 |
11.下列有机物中,不属于烃的衍生物的是( )
| A. | 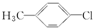 | B. | CH3CH2NO2 | C. | CH2=CHBr | D. | CΗ3-CH3 |
1.已知锌与稀盐酸反应放热.某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气.所用稀盐酸浓度为1.00mol•L-1、2.00mol•L-1,锌有细颗粒与粗颗粒两种规格,用量为6.50g.实验温度为298K、308K,每次实验稀盐酸的用量为25.0mL.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
(2)实验①记录如下:
①计算在30-40s范围内盐酸的平均反应速率v(HCl)=0.56mol/(L•s).(忽略溶液体积变化,不需要写出计算过程).
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
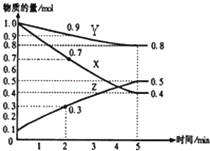
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.
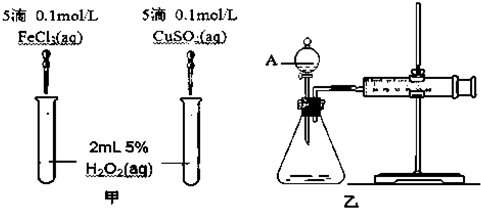
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S…)为40~50S,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率:
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);
(4)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如右图所示.该反应的化学方程式为:3X+Y?2Z.

(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察生成气泡的快慢判断,
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是产生40ml气体所需要的时间.

5.如表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)非金属性最强的是F(填元素符号)、化学性质最不活泼的是Ar(填元素符号).
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: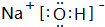 或
或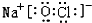 .
.
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(4)表中能形成两性氢氧化物的元素是Al(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:向H2S溶液中通入O2,若溶液出现浑浊,说明O2的氧化性比S强.
| 族 周期 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
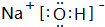 或
或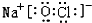 .
.(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(4)表中能形成两性氢氧化物的元素是Al(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:向H2S溶液中通入O2,若溶液出现浑浊,说明O2的氧化性比S强.