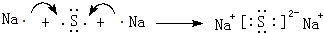题目内容
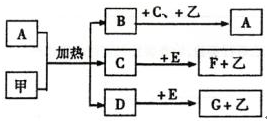
8.下列A-I九种物质之间的转化关系如图所示;其中部分生成物或反应条件已略去.已知A为固态单质,常温下C、E、F都是无色气体.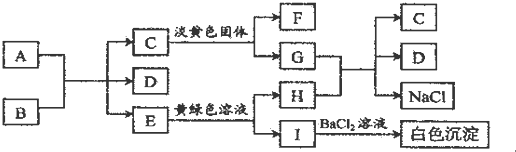
请填空:
(1)F的化学式(分子式)是O2,题中淡黄色固体中阴阳离子个数比为1:2.
(2)A与B反应的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(3)E转变为H和I的离子方程式是SO2+Cl2+2H2O═4H++2Cl-+SO42-
(4)现有少量I与BaCl2生成的白色沉淀,简述该沉淀中阴离子的检验操作先加稀盐酸,再加氯化钡溶液.
分析 根据图中各物质转化关系,A为固态单质,常温下C、E、F都是无色气体,则A与B的反应应为碳与浓酸硫或浓硝酸的反应,E能与黄绿色溶液(应为氯水)反应,生成I遇氯化钡有白色沉淀,则I中应含有硫酸根,I为H2SO4,H为HCl,所以A与B的反应为碳与浓硫酸的反应,A为C,B为浓H2SO4,E为SO2,D为H2O,C是气体能与淡黄色固体反应,则应为二氧化碳与过氧化钠的反应,所以C为CO2,F为O2,G为Na2CO3,HCl与Na2CO3反应生成二氧化碳、氯化钠和水,符合各物质转化关系,据此答题.
解答 解:根据图中各物质转化关系,A为固态单质,常温下C、E、F都是无色气体,则A与B的反应应为碳与浓酸硫或浓硝酸的反应,E能与黄绿色溶液(应为氯水)反应,生成I遇氯化钡有白色沉淀,则I中应含有硫酸根,I为H2SO4,H为HCl,所以A与B的反应为碳与浓硫酸的反应,A为C,B为浓H2SO4,E为SO2,D为H2O,C是气体能与淡黄色固体反应,则应为二氧化碳与过氧化钠的反应,所以C为CO2,F为O2,G为Na2CO3,HCl与Na2CO3反应生成二氧化碳、氯化钠和水,符合各物质转化关系,
(1)F为O2,题中淡黄色固体为过氧化钠,过氧化钠中阴阳离子个数比为1:2,
故答案为:O2;1:2;
(2)A与B反应的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(3)E转变为H和I的离子方程式是SO2+Cl2+2H2O═4H++2Cl-+SO42-,
故答案为:SO2+Cl2+2H2O═4H++2Cl-+SO42-;
(4)I为H2SO4,少量I与BaCl2生成的白色沉淀为硫酸钡,该沉淀中阴离子的检验操作为先加稀盐酸,再加氯化钡溶液,
故答案为:先加稀盐酸,再加氯化钡溶液.
点评 本题考查无机物的推断,题目难度中等,物质的颜色为解答该题的突破口,注意把握反应的转化关系的重要信息,侧重于学生分析能力的考查,注意相关知识的学习.

 阅读快车系列答案
阅读快车系列答案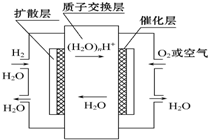
| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 导电离子为质子,且在电池内部由正极定向移向负极 | |
| D. | 总反应式为2H2+O2=2H2O |
| A. | 地球上绝大多数金属元素是以游离态存在于自然界中的 | |
| B. | 在化学反应中,金属容易失去电子,是还原剂 | |
| C. | 多数合金的熔点高于组成它的成分的金属的熔点 | |
| D. | 硅单质是良好的半导体,所以它是金属元素 |
| A. | 氯化钠溶于水 | B. | 氯化氢溶于水 | C. | 干冰汽化 | D. | 加热分解氯化铵 |
| A. | SiO2是太阳能电池的主要原料 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | 金属的镀层被破坏后,镀锌铁比镀铜铁更容易被腐蚀 | |
| D. | 明矾净水是因为能生成有吸附性的物质 |
①C2H5-SO3H ②C6H5NO2 ③
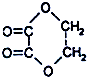 ④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.
④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.| A. | ①②⑤ | B. | ①②⑦ | C. | ②③⑧ | D. | ④⑥⑨ |
| 元素代号 | X | Y | Z | W | T |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.074 | 0.071 |
| 主要化合价 | +1 | +3 | +6、-2 | -2 | -1、无正价 |
| A. | X与W形成的化合物中都只含离子键 | |
| B. | Z的氢化物与T的单质具有相同的核外电子数 | |
| C. | Y、X的最高价氧化物的水化物之间能反应 | |
| D. | Z的氧化物不止一种 |
 .
. .
.