题目内容
11.下列有机物中,不属于烃的衍生物的是( )| A. | 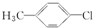 | B. | CH3CH2NO2 | C. | CH2=CHBr | D. | CΗ3-CH3 |
分析 A.对氯甲苯含有官能团-Cl,属于烃的衍生物;
B.硝基乙烷的官能团为硝基,属于烃的衍生物;
C.CH2=CHBr的官能团为碳碳双键和-Br,属于烃的衍生物;
D.烃的衍生物是烃分子中的氢原子被其他原子或者原子团所取代而生成的一系列化合物.
解答 解:烃分子中的氢原子被其他原子或者原子团所取代而生成的一系列化合物称为烃的衍生物,其中取代氢原子的其他原子或原子团使烃的衍生物具有不同于相应烃的特殊性质,被称为官能团.
A.对氯甲苯含有官能团-Cl,属于烃的衍生物,故A错误;
B.硝基乙烷的官能团为硝基,属于烃的衍生物,故B错误;
C.CH2=CHBr的官能团为碳碳双键和-Br,属于烃的衍生物,故C错误;
D.烃分子中的氢原子被其他原子或者原子团所取代而生成的一系列化合物称为烃的衍生物,而CΗ3-CH3属于烃,故D错误.
故选D.
点评 本题考查了常见有机物的分类方法,题目难度不大,注意掌握常见有机物的分子组成、含有的官能团类型及有机物的分类方法,明确烃的衍生物的概念.

练习册系列答案
相关题目
2.氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料.
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该可逆反应达到平衡的标志是BCE.
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(3)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
则从反应开始到25min时,以N2表示的平均反应速率=0.01mol/(L.min);该温度下平衡常数K=2.37(mol/L)-2;(要写K的单位)
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(1)═H2O(g)△H=+44.0kJ•mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0kJ•mol-1;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是a Pa(用含a的式子表示).
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该可逆反应达到平衡的标志是BCE.
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(3)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)?CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(1)═H2O(g)△H=+44.0kJ•mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-87.0kJ•mol-1;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于400K下分解,平衡时体系压强为a Pa,若反应温度不变,将体系的体积增加50%,则体系的压强是a Pa(用含a的式子表示).
6.下列不能说明氯元素的非金属性比硫元素强的事实( )
| A. | 氯化氢比硫化氢稳定 | B. | 次氯酸的氧化性比硫酸强 | ||
| C. | 高氯酸的酸性比硫酸的强 | D. | 氯气能与硫化氢反应生成硫 |
16.如图,有关零排放车载燃料电池叙述正确的是( )
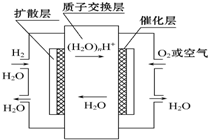

| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 导电离子为质子,且在电池内部由正极定向移向负极 | |
| D. | 总反应式为2H2+O2=2H2O |
3.在人类社会的发展进程中,金属起着重要的作用.下列说法正确的是( )
| A. | 地球上绝大多数金属元素是以游离态存在于自然界中的 | |
| B. | 在化学反应中,金属容易失去电子,是还原剂 | |
| C. | 多数合金的熔点高于组成它的成分的金属的熔点 | |
| D. | 硅单质是良好的半导体,所以它是金属元素 |
20.下列说法正确的是( )
| A. | SiO2是太阳能电池的主要原料 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | 金属的镀层被破坏后,镀锌铁比镀铜铁更容易被腐蚀 | |
| D. | 明矾净水是因为能生成有吸附性的物质 |
 .
. .
.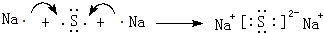
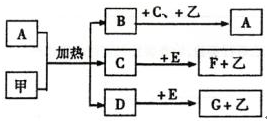
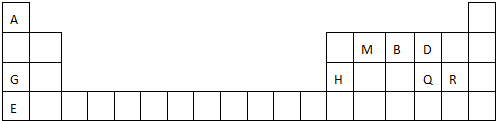
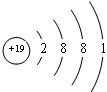
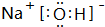 ; 用电子式表示G与Q形成化合物的过程
; 用电子式表示G与Q形成化合物的过程 ;
;