题目内容
5.如表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:| 族 周期 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)由①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
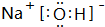 或
或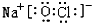 .
.(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(填化学式)
(4)表中能形成两性氢氧化物的元素是Al(填元素符号),分别写出该元素的氢氧化物与⑥、⑧最高价氧化物的水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
(5)请设计一个实验方案,比较④、⑧单质氧化性的强弱,并描述现象和结论:向H2S溶液中通入O2,若溶液出现浑浊,说明O2的氧化性比S强.
分析 由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S、⑨为Cl、⑩为Ar.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱;稀有气体元素原子最外层为稳定结构,化学性质最不活泼;
(2)①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等;
(3)非金属性越强,最高价含氧酸的酸性越强,高氯酸是最强的无机含氧酸;
(4)氢氧化铝是两性氢氧化物,⑥、⑧最高价氧化物的水化物分别为氢氧化钠、硫酸,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,与硫酸反应生成硫酸铝与水;
(5)利用单质之间的相互置换反应进行设计.
解答 解:由元素在周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S、⑨为Cl、⑩为Ar.
(1)同周期自左而右非金属性增强、同主族自上而下非金属性减弱,故上述元素中F元素的非金属性最强;稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,
故答案为:F;Ar;
(2)①、④、⑥、⑨中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等,对应电子式为: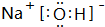 、
、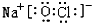 ,
,
故答案为: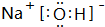 或
或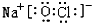 ;
;
(3)非金属性N>C,非金属性越强,最高价含氧酸的酸性越强,高氯酸是最强的无机含氧酸,故酸性:HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(4)铝元素氧化物对应水化物氢氧化铝是两性氢氧化物,⑥、⑧最高价氧化物的水化物分别为氢氧化钠、硫酸,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,与硫酸反应生成硫酸铝与水,相应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,
故答案为:铝Al;Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;
(5)向H2S溶液中通入O2,若溶液出现浑浊,说明O2的氧化性比S强,
故答案为:向H2S溶液中通入O2,若溶液出现浑浊,说明O2的氧化性比S强.
点评 本题考查元素周期表与元素周期律应用,侧重对元素周期律的考查,有利于基础知识的巩固,注意(5)中实验方案的设计,难度不大.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H1=a kJ/mol
CO(g)+H2O(g)?CO2(g)+H2(g)△H2=b kJ/mol
2CO(g)+O2(g)?2CO2(g)△H3=c kJ/mol
(1)求反应CH4(g)+CO2(g)?CO(g)+2H2(g)△H=a+2b-2c kJ/mol(用含a、b、c的代数式表示).
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为3CO+3H2═CH3OCH3+CO2.
(3)用Cu2Al2O4做催化剂,一定条件下发生反应:
CO2(g)+CH4(g)?CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
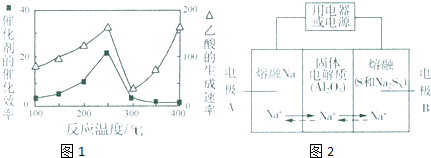
①250~300℃时,乙酸的生成速率降低的原因是催化剂的催化效率降低,化学反应速率降低.
②300~400℃时,乙酸的生成速率升高的原因是温度升高,化学反应速率加快.
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃
C.300℃~350℃D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是AD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.05mol,两极的反应物的质量差为2.3 g.(假设电解前两极的反应物的质量相等)
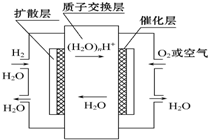
| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 导电离子为质子,且在电池内部由正极定向移向负极 | |
| D. | 总反应式为2H2+O2=2H2O |
| A. | 氯化钠溶于水 | B. | 氯化氢溶于水 | C. | 干冰汽化 | D. | 加热分解氯化铵 |
| A. | SiO2是太阳能电池的主要原料 | |
| B. | 油脂和蛋白质都是高分子化合物 | |
| C. | 金属的镀层被破坏后,镀锌铁比镀铜铁更容易被腐蚀 | |
| D. | 明矾净水是因为能生成有吸附性的物质 |
| A. | 煤经分馏得到了煤焦油,从中可分离出苯、甲苯、二甲苯等有机化合物 | |
| B. | 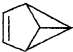 的一氯代物有3种 的一氯代物有3种 | |
| C. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| D. | 木糖醇(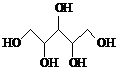 )和葡萄糖( )和葡萄糖(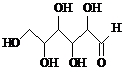 ),互为同系物,均属于糖类 ),互为同系物,均属于糖类 |
①C2H5-SO3H ②C6H5NO2 ③
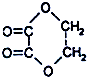 ④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.
④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.| A. | ①②⑤ | B. | ①②⑦ | C. | ②③⑧ | D. | ④⑥⑨ |
| A. | S2-的结构示意图: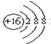 | B. | 氯气的电子式:Cl:Cl | ||
| C. | 氧-18的原子符号:${\;}_{8}^{18}$O | D. | CO2分子的结构式:O=C=O |
| A. | 0.22 mol•(L•min)-1 | B. | 0.1 mol•(L•min)-1 | ||
| C. | 0.04 mol•(L•min)-1 | D. | 0.08 mol•(L•min)-1 |