题目内容
6.下列关于晶体的说法正确的组合是( )①离子晶体中都存在离子键,肯定没有共价键
②分子晶体中都存在共价键,肯定没有离子键
③金刚石、SiC、NaF、NaCl、H2O、H2Se晶体的熔点依次降低
④在晶体中只要有阴离子就一定有阳离子
⑤金属晶体的熔点普遍都很高
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦分子晶体中分子间作用力越大,分子越稳定.
| A. | ①②③⑥ | B. | ②④⑥ | C. | ③⑤⑥⑦ | D. | ③④ |
分析 ①共价键可以存在于共价化合物、离子化合物和单质中;
②分子晶体中不一定存在化学键;
③根据晶体类型判断熔点高低;
④根据晶体要呈电中性来分析;
⑤汞在常温下为液态;
⑥原子晶体中非金属原子之间的作用力为共价键,Si原子能形成4个共价键;
⑦分子间作用力与分子稳定性无关.
解答 解:①共价键可以存在于共价化合物、离子化合物和单质中,故离子晶体中可以存在共价键,故①错误;
②分子晶体中不一定存在化学键,如稀有气体中不存在任何化学键,故②错误;
③晶体中熔点高低一般顺序是:原子晶体>离子晶体>分子晶体;在原子晶体中,原子半径越大熔点越低;在离子晶体中,离子半径越大,熔点越低,电荷越多,熔点越高;在分子晶体中,物质的熔点与相对分子质量成正比(含有氢键的物质除外),所以这几种物质的熔点高低顺序是:金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低,故③正确;
④根据晶体要呈电中性可知,晶体中含阴离子就一定含阳离子,故④正确;
⑤金属汞在常温下为液态,故金属晶体的熔点不一定高,故⑤错误;
⑥原子晶体中非金属原子之间的作用力为共价键,则SiO2晶体中每个硅原子能形成4个共价键,则每个Si与4个氧原子以共价键相结合,故⑥错误;
⑦分子的稳定性属于化学性质,与共价键有关,分子间作用力与稳定性无关,故⑦错误.
故选D.
点评 本题考查的知识点较多,涉及共价键、离子键、分子间作用力、晶体熔点比较等,题目侧重于基础知识的考查,难度不大,注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.如图,有关零排放车载燃料电池叙述正确的是( )

| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 导电离子为质子,且在电池内部由正极定向移向负极 | |
| D. | 总反应式为2H2+O2=2H2O |
17.下列各组化合物中不属于酯类的一组化合物是( )
①C2H5-SO3H ②C6H5NO2 ③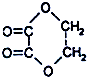 ④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.
④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.
①C2H5-SO3H ②C6H5NO2 ③
 ④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.
④CH3OCOCH3 ⑤(COOC2H5)2 ⑥C2H5OCOOC2H5 ⑦CH3-COCH2O-CH3 ⑧CH3OCOOH ⑨HCOOCH3.| A. | ①②⑤ | B. | ①②⑦ | C. | ②③⑧ | D. | ④⑥⑨ |
14.下列化学用语的表示不正确的是( )
| A. | S2-的结构示意图: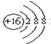 | B. | 氯气的电子式:Cl:Cl | ||
| C. | 氧-18的原子符号:${\;}_{8}^{18}$O | D. | CO2分子的结构式:O=C=O |
18.几种短周期元素的原子半径及主要化合价如下表,下列叙述不正确的是( )
| 元素代号 | X | Y | Z | W | T |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.074 | 0.071 |
| 主要化合价 | +1 | +3 | +6、-2 | -2 | -1、无正价 |
| A. | X与W形成的化合物中都只含离子键 | |
| B. | Z的氢化物与T的单质具有相同的核外电子数 | |
| C. | Y、X的最高价氧化物的水化物之间能反应 | |
| D. | Z的氧化物不止一种 |
15.某一反应物的浓度是2.0mol•L-1,经过2min后,它的浓度变成了1.56mol•L-1,则在这2min内它的平均反应速率为( )
| A. | 0.22 mol•(L•min)-1 | B. | 0.1 mol•(L•min)-1 | ||
| C. | 0.04 mol•(L•min)-1 | D. | 0.08 mol•(L•min)-1 |
16.石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收E kJ的能量,下列说法正确的是( )
| A. | 石墨不如金刚石稳定 | |
| B. | 金刚石和石墨互为同位素 | |
| C. | 石墨能量高于金刚石 | |
| D. | 等质量的金刚石与石墨完全燃烧,石墨放出的能量少 |
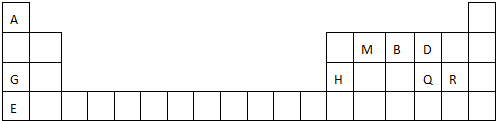
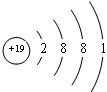
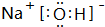 ; 用电子式表示G与Q形成化合物的过程
; 用电子式表示G与Q形成化合物的过程 ;
;