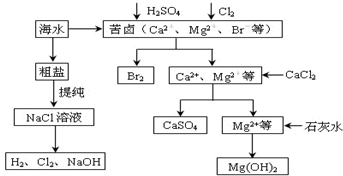
题目内容
5.惕各酸苯乙酯(C13H16O2)广泛用作香精的调香剂.为了合成该物质,某实验室的科技人员设计了下列合成路线: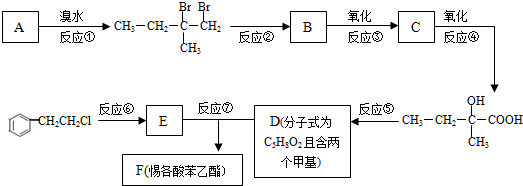
试回答下列问题:
(1)F的结构简式为
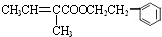 .
.(2)反应②中另加的试剂是氢氧化钠水溶液;反应⑤的一般条件是浓硫酸、加热.
(3)反应③的化学方程式为
 .
.(4)上述合成路线中属于取代反应的是②⑥⑦(填编号).
分析 由A与溴发生加成反应的产物可知,A的结构简式为CH3CH2C(CH3)=CH2,B可以连续发生氧化反应,故反应②为卤代烃的在氢氧化钠水溶液、加热条件下发生水解反应,则B为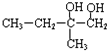 ,B发生氧化反应生成C为
,B发生氧化反应生成C为 ,C进一步发生氧化反应生成
,C进一步发生氧化反应生成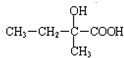 ,D的分子式为C5H8O2,分子中含有2个甲基,可知
,D的分子式为C5H8O2,分子中含有2个甲基,可知 发生消去反应生成D,故D的结构简式为
发生消去反应生成D,故D的结构简式为 ,反应⑥为卤代烃的在氢氧化钠水溶液、加热条件下发生水解反应,则E为
,反应⑥为卤代烃的在氢氧化钠水溶液、加热条件下发生水解反应,则E为 ,反应⑦为酯化反应,则F为
,反应⑦为酯化反应,则F为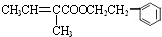 ,据此解答.
,据此解答.
解答 解:由A与溴发生加成反应的产物可知,A的结构简式为CH3CH2C(CH3)=CH2,B可以连续发生氧化反应,故反应②为卤代烃的在氢氧化钠水溶液、加热条件下发生水解反应,则B为 ,B发生氧化反应生成C为
,B发生氧化反应生成C为 ,C进一步发生氧化反应生成
,C进一步发生氧化反应生成 ,D的分子式为C5H8O2,分子中含有2个甲基,可知
,D的分子式为C5H8O2,分子中含有2个甲基,可知 发生消去反应生成D,故D的结构简式为
发生消去反应生成D,故D的结构简式为 ,反应⑥为卤代烃的在氢氧化钠水溶液、加热条件下发生水解反应,则E为
,反应⑥为卤代烃的在氢氧化钠水溶液、加热条件下发生水解反应,则E为 ,反应⑦为酯化反应,则F为
,反应⑦为酯化反应,则F为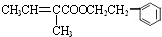 .
.
(1)F的结构简式为: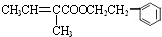 ,故答案为:
,故答案为: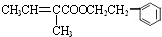 ;
;
(2)反应②为卤代烃的在氢氧化钠水溶液、加热条件下发生水解反应,反应⑤为醇再浓硫酸、加热条件下发生的消去反应,故答案为:氢氧化钠水溶液;浓硫酸、加热;
(3)反应③的化学方程式为: ,
,
故答案为: ;
;
(4)反应①属于加成反应,反应②⑥⑦属于取代反应,反应③④属于氧化反应,反应⑤属于消去反应,故答案为:②⑥⑦.
点评 本题考查有机物的推断与合成,注意根据A的加成反应产物结构与反应条件进行推断,需要学生熟练掌握官能团的性质与转化,题目难度中等.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 18 g水中所含电子的物质的量为10 mol | |
| B. | N2和CO的摩尔质量相等,都是28 | |
| C. | 1 mol CO2的质量为44 g•mol-1 | |
| D. | 硫酸和磷酸的摩尔质量均为98 g |
16.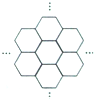 据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
 据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )| A. | 碳膜片属于碳元素的同素异形体 | |
| B. | 碳膜片与C60是同一种物质 | |
| C. | 碳膜片属于人工合成的有机高分子材料 | |
| D. | 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 |
20.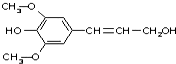 膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
 膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇能发生的反应类型有氧化、取代、水解、加聚 | |
| B. | 芥子醇的分子式是C11H14O4,属于芳香烃 | |
| C. | 芥子醇分子中所有碳原子可能在同一平面 | |
| D. | 芥子醇能与3mol溴水反应 |
10.阿伏伽德罗常数约为6.02×1023mol-1,下列叙述中不正确的是( )
| A. | 0.1 mol OH-含有6.02×1023个电子 | |
| B. | 氯化氢气体的摩尔质量等于6.02×1023氯气分子和6.02×1023个氢分子的质量之和 | |
| C. | 1 mol醋酸的质量与6.02×1023个醋酸分子的质量相等 | |
| D. | 28 g氮气所含的原子数目为12.04×1023 |
14.某同学用某种粗盐进行提纯实验,步骤见下图.请回答:
(1)步骤②的操作名称是过滤.
(2)步骤③发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止局部温度过高而溅出液体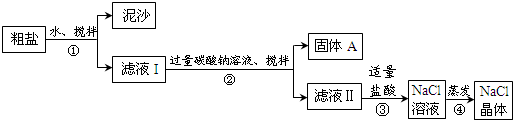
(3)猜想和验证:
(1)步骤②的操作名称是过滤.
(2)步骤③发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止局部温度过高而溅出液体

(3)猜想和验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ①有气泡冒出且澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入②稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ③猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, ④加入硝酸酸化的硝酸钡溶液 | ⑤产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
15.下列各组物质发生反应后,只可能生成一种气体产物的是( )
| A. | 木炭在氧气中燃烧 | B. | 铁粉与高温水蒸气反应 | ||
| C. | 碳酸氢铵受热分解 | D. | Na2O2加入氯化铵溶液中 |
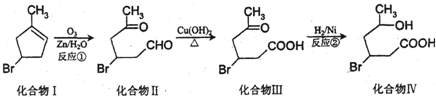
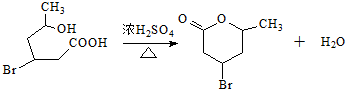 .
.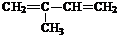 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为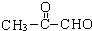 、HCHO.
、HCHO.