题目内容
17.工业上对海水资源综合开发利用的部分工艺流程如图所示.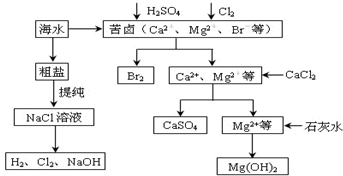
(1)为有效除去粗盐中的Ca2+、Mg2+、SO42-等杂质,加入试剂的合理顺序为BC.
A.先加NaOH,后加Na2CO3,再加BaCl2
B.先加NaOH,后加BaCl2,再加Na2CO3
C.先加BaCl2,后加NaOH,再加Na2CO3
(2)在隔膜法电解食盐水时,电解槽阳极区的电极反应式为2Cl--2e-=Cl2↑;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为NaCl+H2O $\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑.
(3)氯碱工业制得的氯气可用于生产半导体材料硅,其流程如下:

①石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是还原剂.
②粗硅与氯气反应后得到的液态四氯化硅中常混有一些杂质,必须进行分离提纯.其提纯方法为蒸馏.
③由四氯化硅得到高纯硅的化学方程式是SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl
(4)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?原因是否,如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯.
(5)工业上采用电解MgCl2的方法制得金属镁,电解槽中阴极的电极反应式为Mg2++2e-=Mg,从MgCl2溶液得到MgCl2固体的方法是在氯化氢气流中加热蒸发;有同学认为可加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,你同意该同学的想法吗?为什么?不同意,因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
分析 (1)加碳酸钠要放在加氯化钡之后,可以同时除去过量的钡离子;
(2)电解饱和氯化钠溶液生成氢氧化钠、氢气和氯气,反应物为氯化钠、水;
(3)①石英砂主要成分为二氧化硅,粗硅提纯是利用碳做还原剂还原二氧化硅为单质硅,二氧化硅和碳在高温下反应生成硅和一氧化碳,反应中二氧化硅为氧化剂,碳为还原剂;
②混合物的沸点不同,可用蒸馏的方法分离;
③根据反应物和生成物结合质量守恒定律书写化学方程式.
(4)根据若先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀;硫酸钙属于微溶物,可以先使其沉淀下来,在沉淀镁离子,若先沉淀镁离子,则会有部分硫酸钙掺杂在氢氧化镁中,使固体不纯;
(5)根据电解时,阴极是阳离子放电,氯化镁溶液中得到氯化镁固体,需要防止镁离子的水解,MgO熔点远高于MgCl2,应注意节约能源.
解答 解:(1)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项BC符合,故答案为:BC;
(2)电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程:2Cl--2e-=Cl2↑;阴极是氢离子得电子生成氢气的过程为2H++2e-=H2↑,采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程 NaCl+H2O $\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑;
故答案为:2Cl--2e-=Cl2↑;NaCl+H2O $\frac{\underline{\;通电\;}}{\;}$NaClO+H2↑;
(3)①石英砂的主要成分是二氧化硅,制备粗硅发生SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,二氧化硅和碳在高温下反应生成硅和一氧化碳,反应中二氧化硅为氧化剂,碳为还原剂,
故答案为:SiO2;还原剂;
②粗硅与氯气反应后得到沸点较低的液态四氯化硅,其中常混有一些高沸点、难挥发性杂质,因沸点不同,则分离提纯法选蒸馏法,故答案为:蒸馏;
③四氯化硅与氢气在高温条件下反应得到高纯硅和氯化氢气体,该反应为SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl↑,
故答案为:SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl↑;
(4)工艺流程中先后制得Br2、CaSO4和Mg(OH)2,不能沉淀Mg(OH)2,硫酸钙为微溶物,如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,使产品不纯,
故答案为:否,如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯;
(5)电解熔融MgCl2可得到金属镁,镁离子在阴极放电,电极反应方程式为:Mg2++2e-=Mg,为防止镁离子水解生成氢氧化镁沉淀,从MgCl2溶液得到MgCl2固体的方法是在氯化氢气流中加热蒸发,MgO熔点远高于MgCl2,应注意节约能源,可用氯化镁代替,
故答案为:Mg2++2e-=Mg;在氯化氢气流中加热蒸发;不同意,因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
点评 本题以从海水中提取镁为背景,考查物质的分离、提纯,盐类水解,电解原理应用,节能减排等知识,培养了学生运用知识的能力,题目难度中等.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| A. | 盐酸与Fe(OH)3反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | Fe3O4与盐酸反应:Fe3O4+8H+═3Fe3++4H2O |
| A. | 把少量液溴、白磷放在水下 | |
| B. | 把铝片、镁条放置在不密封的纸盒里 | |
| C. | 把汽油、溴水放在带橡皮塞的玻璃试剂瓶中 | |
| D. | 把硝酸、硝酸银放在配有磨口玻璃塞的棕色瓶中 |
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
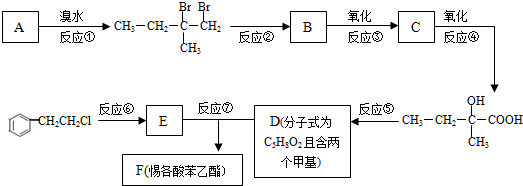
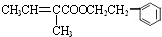 .
. .
.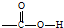
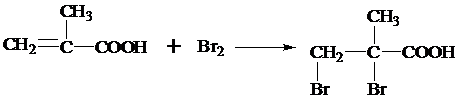 ,反应类型为加成反应.
,反应类型为加成反应.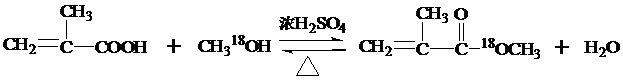 ,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为
,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为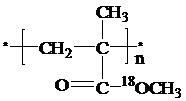 .
.