题目内容
10.阿伏伽德罗常数约为6.02×1023mol-1,下列叙述中不正确的是( )| A. | 0.1 mol OH-含有6.02×1023个电子 | |
| B. | 氯化氢气体的摩尔质量等于6.02×1023氯气分子和6.02×1023个氢分子的质量之和 | |
| C. | 1 mol醋酸的质量与6.02×1023个醋酸分子的质量相等 | |
| D. | 28 g氮气所含的原子数目为12.04×1023 |
分析 A、OH-是10电子微粒;
B、摩尔质量的单位为g/mol,质量的单位为g;
C、1mol醋酸中含6.02×1023个醋酸分子;
D、根据氮气由氮原子构成来分析.
解答 解:A、OH-是10电子微粒,即1mol氢氧根中含10mol电子,则0.1mol氢氧根中含1mol电子即NA个,故A正确;
B、摩尔质量即单位物质的量的物质所具有的质量,单位为g/mol,HCl的摩尔质量为36.5g/mol;而质量的单位为g,6.02×1023氯气分子和6.02×1023个氢分子的质量分别为71g和2g,即质量之和为73g,故B错误;
C、1mol醋酸中含6.02×1023个醋酸分子,则1 mol醋酸的质量与6.02×1023个醋酸分子的质量相等,故C正确;
D、氮气由氮原子构成,则28g氮气中含有的氮原子的物质的量n=$\frac{28g}{14g/mol}$=2mol,即12.04×1023个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的计算以及物质的结构特点是解题关键,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
20.下述实验方案不能达到实验目的是( )
| A. |  目的:验证乙炔的还原性 | |
| B. |  目的:收集氨气 | |
| C. |  操作:片刻后在Fe电极附近滴入 K3[Fe(CN)6]溶液,目的:验证Fe电极被保护 | |
| D. | 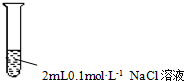 操作:①加入3滴同浓度的AgNO3溶液、②再加入3滴同浓度的Na2S溶液,目的:验证AgCl的溶解度大于Ag2S |
1.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 工业制铝的原料是AlCl3,可以降低能耗 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |
15.对下列实验现象的解释正确的是( )
| 现 象 | 解 释 | |
| A | Na2O2 投入到 FeCl2 溶液中得到大量红褐色沉淀 | Na2O2 具有还原性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
19.以NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA | |
| B. | 28 g CO中所含的原子数为2 NA | |
| C. | 0.1 mol•L-1Na2CO3溶液中,含有CO32-数为0.1 NA | |
| D. | 标准状况下,22.4 L苯的分子数为NA |
20.现有容积固定的密闭容器内有反应X(g)+2Y(g)═2Z(g);△H=akJ/mol(a>0),若向密闭容器中通入1molX和2molY,达平衡状态时,吸收热量bkJ;则下列判断正确的是( )
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a=b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 该反应达到化学平衡状态时,密闭容器内气体的物质的量一定不变 |
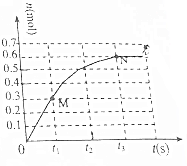 T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.
T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.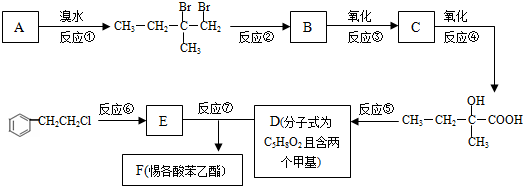
 .
. .
.
 ,反应类型为加成反应.
,反应类型为加成反应. ,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为
,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为 .
.