题目内容
15.下列各组物质发生反应后,只可能生成一种气体产物的是( )| A. | 木炭在氧气中燃烧 | B. | 铁粉与高温水蒸气反应 | ||
| C. | 碳酸氢铵受热分解 | D. | Na2O2加入氯化铵溶液中 |
分析 A、木炭和氧气反应可以生成一氧化碳、二氧化碳;
B、铁和水蒸气反应生成四氧化三铁和氢气;
C、碳酸氢铵受热分解生成氨气、二氧化碳和水蒸气;
D、过氧化钠和氯化铵溶液反应生成氧气和氨气;
解答 解:A、木炭和氧气反应可以不充分燃烧生成一氧化碳、充分燃烧生成二氧化碳,故A错误;
B、铁和水蒸气反应生成四氧化三铁和氢气,只可能生成一种气体产物,故B正确;
C、碳酸氢铵受热分解生成氨气、二氧化碳和水蒸气,不只生成一种气体产物,故C错误;
D、过氧化钠和氯化铵溶液反应,与水反应生成氢氧化钠和氧气,氢氧化钠和氯化铵反应生成氨气,故D错误;
故选B.
点评 本题考查了物质性质的分析判断,主要是产物判断,注意过氧化钠和水反应生成氧气和氢氧化钠,氢氧化钠和氯化铵反应生成氨气,题目较简单.

练习册系列答案
相关题目
6.能正确表示下列反应的离子方程式为( )
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
20.现有容积固定的密闭容器内有反应X(g)+2Y(g)═2Z(g);△H=akJ/mol(a>0),若向密闭容器中通入1molX和2molY,达平衡状态时,吸收热量bkJ;则下列判断正确的是( )
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a=b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 该反应达到化学平衡状态时,密闭容器内气体的物质的量一定不变 |
4.若NA表示阿伏伽德罗常数则下列说法正确的是( )
| A. | 标准状况下,22.4LHF分子中所含的原子数约为2NA | |
| B. | 1mol冰中,平均所含氢键的数目为NA | |
| C. | 在氧化还原反应中,1molH2O2转移的电子数为2NA | |
| D. | 13gCnHn分子中最多含C-C数为1.5NA |
5.Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
(1)写出上述实验中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图1所示,则A、B、C三点所表示的即时反应速率最慢的是C.
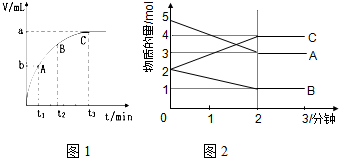
Ⅱ.某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图2所示(A,B,C均为气体,且A气体有颜色).
(4)该反应的化学方程式为2A+B?2C.
(5)反应开始至2分钟时,B的平均反应速率为0.1mol/(L•min).
(6)能说明该反应已达到平衡状态的是cd
a.v(A)=2v(B) b.容器内各物质的物质的量相等
c.v烂(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为40%.
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的颗粒大小有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图1所示,则A、B、C三点所表示的即时反应速率最慢的是C.

Ⅱ.某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图2所示(A,B,C均为气体,且A气体有颜色).
(4)该反应的化学方程式为2A+B?2C.
(5)反应开始至2分钟时,B的平均反应速率为0.1mol/(L•min).
(6)能说明该反应已达到平衡状态的是cd
a.v(A)=2v(B) b.容器内各物质的物质的量相等
c.v烂(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的转化率为40%.
 .
. .
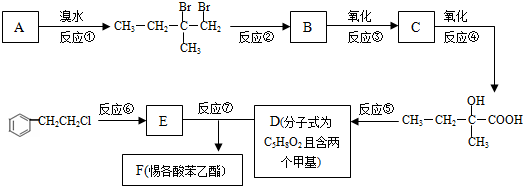
.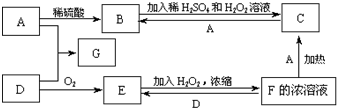 中学化学中几种常见物质的转化关系如图(有部分产物未画出).A是一种金属单质,D是一种非金属固体单质.
中学化学中几种常见物质的转化关系如图(有部分产物未画出).A是一种金属单质,D是一种非金属固体单质.