题目内容
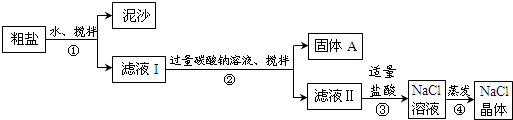
14.某同学用某种粗盐进行提纯实验,步骤见下图.请回答:(1)步骤②的操作名称是过滤.
(2)步骤③发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止局部温度过高而溅出液体
(3)猜想和验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ①有气泡冒出且澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入②稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ③猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, ④加入硝酸酸化的硝酸钡溶液 | ⑤产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
分析 粗盐溶于水,然后采用过滤方法除去难溶性泥沙,得到滤液I,向滤液中加入过量碳酸钠溶液,搅拌,然后过滤除去难溶性固体A,得到滤液II,向滤液中加入适量稀盐酸,碳酸钠溶于稀盐酸得到氯化钠,将氯化钠溶液蒸发浓缩、冷却结晶得到氯化钠晶体;
(1)分离难溶性固体和溶液采用过滤方法;
(2)碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水;步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止溅出液体;
(3)猜想I.碳酸盐能和稀盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊;
猜想II.碳酸根离子可以用稀盐酸或稀硝酸检验,钡离子可以用可溶性的硫酸盐检验;
猜想III.要鉴定该混合物中的硫酸根离子,可以用硝酸酸化的硝酸钡溶液检验.
解答 解:粗盐溶于水,然后采用过滤方法除去难溶性泥沙,得到滤液I,向滤液中加入过量碳酸钠溶液,搅拌,然后过滤除去难溶性固体A,得到滤液II,向滤液中加入适量稀盐酸,碳酸钠溶于稀盐酸得到氯化钠,将氯化钠溶液蒸发浓缩、冷却结晶得到氯化钠晶体;
(1)分离难溶性固体和溶液采用过滤方法,步骤②目的是除去难溶性固体A,采用过滤方法即可,故答案为:过滤;
(2)碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,反应方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑;步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止局部温度过高而溅出液体,产生安全事故,
故答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;防止局部温度过高而溅出液体;
(3)猜想I.碳酸盐能和稀盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以可以用澄清石灰水检验二氧化碳,如果有气泡冒出且澄清石灰水变浑浊,则说明猜想I成立;
猜想II.碳酸根离子可以用稀盐酸或稀硝酸检验,所以滴加的试剂是稀盐酸或稀硝酸,钡离子可以用可溶性的硫酸盐检验,如果有气泡冒出说明含有碳酸根离子,如果不产生白色沉淀说明不含钡离子,则猜想II不成立;
猜想III.该物质中要检验硫酸根离子可以用硝酸酸化的硝酸钡溶液,所以④为滴入硝酸酸化的硝酸钡溶液,如果产生不溶于稀硝酸的白色沉淀,说明猜想III成立,
故答案为:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 有气泡冒出且烧杯中产生白色沉淀 | ||
| 猜想Ⅱ:固体A中含BaCO3 | 稀盐酸或稀硝酸 | 有气泡放出,无白色沉淀 | 猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 加入硝酸酸化的硝酸钡溶液 | 产生不溶于稀硝酸的白色沉淀 |
点评 本题以粗盐提纯为载体考查基本实验操作及探究物质组成,为高频考点,明确基本操作方法及物质性质是解本题关键,知道粗盐提纯中发生的反应及操作方法,会根据物质性质差异性选取合适试剂检验物质,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA | |
| B. | 28 g CO中所含的原子数为2 NA | |
| C. | 0.1 mol•L-1Na2CO3溶液中,含有CO32-数为0.1 NA | |
| D. | 标准状况下,22.4 L苯的分子数为NA |
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| D. | 硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
| A. | 标准状况下,22.4LHF分子中所含的原子数约为2NA | |
| B. | 1mol冰中,平均所含氢键的数目为NA | |
| C. | 在氧化还原反应中,1molH2O2转移的电子数为2NA | |
| D. | 13gCnHn分子中最多含C-C数为1.5NA |
 .
. .
.
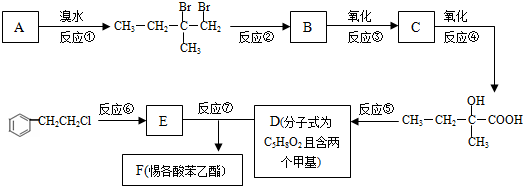
 ,反应类型为加成反应.
,反应类型为加成反应. ,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为
,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为 .
.