题目内容
15.下列说法正确的是( )| A. | 18 g水中所含电子的物质的量为10 mol | |
| B. | N2和CO的摩尔质量相等,都是28 | |
| C. | 1 mol CO2的质量为44 g•mol-1 | |
| D. | 硫酸和磷酸的摩尔质量均为98 g |
分析 A.18 g水物质的量为1mol,水分子是10电子微粒;
B.摩尔质量的单位是g/mol;
C.质量的单位是g;
D.摩尔质量的单位是g/mol.
解答 解:A.18 g水物质的量为1mol,水分子是10电子微粒,所以1mol水分子所含电子的物质的量为10 mol,故A正确;
B.N2和CO的摩尔质量相等,都是28g/mol,故B错误;
C.1mol CO2的质量为44 g,故C错误;
D.硫酸和磷酸的摩尔质量均为98 g/mol,故D错误.
故选A.
点评 本题考查了摩尔质量及其计算,质量换算物质的量计算微粒数,稀有气体是单原子分子是解题关键,题目难度不大.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
13.现有如下各种说法,正确的是
①在水中氢、氧原子间均以化学键相结合
②分子中键能越大,键长越长,则分子越稳定
③干冰受热变为气体和碘升华所克服的粒子间作用力属于同种类型
④H2S和CS2分子都是含有极性键的极性分子
⑤气态双原子分子中肯定存在着σ键,可能存在着π键
⑥CH4、NH3、CCl4分子的空间构型是正四面体形( )
①在水中氢、氧原子间均以化学键相结合
②分子中键能越大,键长越长,则分子越稳定
③干冰受热变为气体和碘升华所克服的粒子间作用力属于同种类型
④H2S和CS2分子都是含有极性键的极性分子
⑤气态双原子分子中肯定存在着σ键,可能存在着π键
⑥CH4、NH3、CCl4分子的空间构型是正四面体形( )
| A. | ②③⑤ | B. | ②⑥ | C. | ③⑤ | D. | ①④⑤ |
20.下述实验方案不能达到实验目的是( )
| A. |  目的:验证乙炔的还原性 | |
| B. |  目的:收集氨气 | |
| C. |  操作:片刻后在Fe电极附近滴入 K3[Fe(CN)6]溶液,目的:验证Fe电极被保护 | |
| D. | 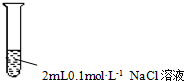 操作:①加入3滴同浓度的AgNO3溶液、②再加入3滴同浓度的Na2S溶液,目的:验证AgCl的溶解度大于Ag2S |
7.能正确表示下列化学反应的离子方程式的是( )
| A. | 盐酸与Fe(OH)3反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | Fe3O4与盐酸反应:Fe3O4+8H+═3Fe3++4H2O |
 某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,其中绿球代表( )元素.
某期刊封面上有如下一个分子的球棍模型图,图中“棍”代表单键或双键或三键.不同颜色的球代表不同元素的原子,其中绿球代表( )元素.
 .
. .
.