题目内容
13.化合物Ⅳ为一种重要化工中间体,其合成方法如下: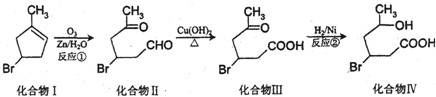
(1)化合物Ⅱ的分子式为C6H9O2Br;反应②的反应类型为加成反应;化合物IV中含有的官能团是羧基、羟基、溴原子.(写名称)
(2)1mol化合物Ⅲ最多消耗2mol NaOH.
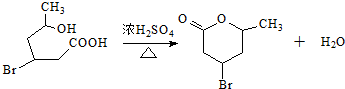
(3)化合物IV在浓硫酸催化下反应生成六元环状酯类化合物,写出该反应的化学方程式
 .
.(4)根据题给化合物转化关系及相关条件,请你推出
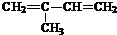 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为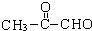 、HCHO.
、HCHO.
分析 (1)根据化合物Ⅱ的结构简式,确定其分子式;对比Ⅲ、Ⅳ的结构可知,Ⅲ中C=O双键与氢气发生加成反应生成Ⅳ;根据化合物IV的结构,可知含有的官能团有羧基、羟基、溴原子;
(2)化合物Ⅲ含有羧基、溴原子,与氢氧化钠发生中和反应、卤代烃的水解反应;
(3)化合物Ⅳ中含有-COOH、-OH,能发生酯化反应生成六元环化合物为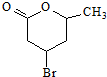 ;
;
(4)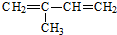 发生类似①的反应,发生氧化反应生成
发生类似①的反应,发生氧化反应生成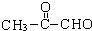 、HCHO.
、HCHO.
解答 解:(1)由化合物Ⅱ结构简式,可知其分子式为C6H9O2Br,对比Ⅲ、Ⅳ的结构可知,Ⅲ中C=O双键与氢气发生加成反应生成Ⅳ;根据化合物IV的结构,可知含有的官能团有羧基、羟基、溴原子,
故答案为:C6H9O2Br;加成反应;羧基、羟基、溴原子;
(2)化合物Ⅲ中-Br、-COOH与NaOH反应,则1mol化合物Ⅲ与足量NaOH反应消耗NaOH的物质的量为2mol,
故答案为:2;
(3)化合物Ⅳ中含有-COOH、-OH,能发生酯化反应生成六元环化合物为 ,该反应方程式为
,该反应方程式为 ,
,
故答案为: ;
;
(4)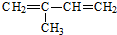 发生类似①的反应,得到有机物Ⅵ和Ⅶ,即发生氧化反应生成
发生类似①的反应,得到有机物Ⅵ和Ⅶ,即发生氧化反应生成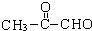 、HCHO,所以Ⅵ和Ⅶ分别为
、HCHO,所以Ⅵ和Ⅶ分别为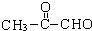 、HCHO,
、HCHO,
故答案为: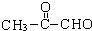 ;HCHO.
;HCHO.
点评 本题考查有机物的合成、有机物的结构与性质,需要学生熟练掌握官能团的性质与转化,题目难度中等.

练习册系列答案
相关题目
1.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 工业制铝的原料是AlCl3,可以降低能耗 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |
8.下列有关试剂的保存方法不正确的是( )
| A. | 把少量液溴、白磷放在水下 | |
| B. | 把铝片、镁条放置在不密封的纸盒里 | |
| C. | 把汽油、溴水放在带橡皮塞的玻璃试剂瓶中 | |
| D. | 把硝酸、硝酸银放在配有磨口玻璃塞的棕色瓶中 |
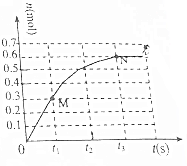 T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.
T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.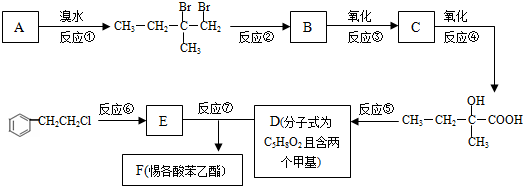
 .
. .
.
 ,反应类型为加成反应.
,反应类型为加成反应. ,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为
,该酯化反应生成的产物在一定条件下可以发生加聚反应得到有机玻璃,有机玻璃的结构简式为 .
.