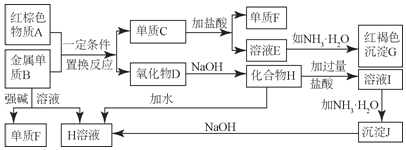
题目内容
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
【答案】温度 不同催化剂(或比较FeCl3溶液和MnO2两种催化剂) 产生气泡的快慢 对照实验只有一条件不同(或避免由于阴离子不同造成的干扰)(或其他合理答案) 收集40 mL O2所需的时间 放 溶液温度升高,反应速率加快 催化剂(或生成的Mn2+催化作用) 取两组等浓度等体积的酸性KMnO4和草酸溶液实验,一组加入少量MnSO4固体,一组不加,比较反应速率
【解析】
影响化学反应速率的因素很多,实验1、2使用相同的催化剂,就可以探究温度对H2O2分解速率的影响.如果催化剂的催化效率高,则产生气泡快。在探究Fe3+和Cu2+对H2O2分解的催化效果时,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰。催化效率越高,则一定时间内产生的气体越多;影响反应速率的因素除了浓度、温度外,催化剂也影响反应速率;根据反应方程式可知,反应产物中锰离子随着反应的进行,浓度变化较大,反应前加入硫酸锰,根据反应速率大小判断锰离子是否在该反应中起到催化作用。
(1)①实验1、2使用相同的催化剂,但温度不同,所以反应速率不同是由温度不同导致的,所以可以探究温度对H2O2分解速率的影响,故答案为:温度;
①试验2、3温度相同,使用不同的催化剂,故该实验比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异,故答案为:比较FeCl3溶液和MnO2两种催化剂对H2O2分解速率影响的差异;
(2)①定性比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过观察产生气泡的快慢来比较,产生气泡快的,催化效果好;在探究Fe3+和Cu2+对H2O2分解的催化效果是,必须保持其他的条件相同,所以将FeCl3改为Fe2(SO4)3更为合理,可以避免由于阴离子不同造成的干扰,
故答案为:反应产生气泡的快慢;控制阴离子相同,排除阴离子的干扰;
②定量比较Fe3+和Cu2+对H2O2分解的催化效果,由图可知,可以通过测定一定时间内产生的气体(或测定产生一定体积的气体所需的时间)来比较。一定时间内产生的气体越多或产生一定体积的气体所需的时间越短,则催化效果越好,故答案为:收集40mL气体所需时间;
(3)①实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快,故该反应为放热反应,导致溶液温度升高,化学反应速率加快,故答案为:放;溶液温度升高,反应速率加快;
②对化学反应速率影响最快的是催化剂,故猜想还可能是催化剂的影响;反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑中,浓度变化较大的为锰离子,所以选择的可以做催化剂的试剂应该含有锰离子,故答案为:催化剂(Mn2+的催化作用);用两组酸性高锰酸钾溶液和草酸溶液作对比实验,一组加入少量MnSO4固体,一组不加,看反应速率快慢。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%