题目内容
【题目】铝及其化合物在生产生活中具有重要的作用。
(1)铝属于活泼金属却能在空气中稳定存在,原因是![]() 用化学用语及相关文字说明表达式为______
用化学用语及相关文字说明表达式为______
(2)下列实验能比较镁和铝的金属性强弱的是______![]() 填字母序号
填字母序号![]()
![]() 测定镁和铝的导电性强弱
测定镁和铝的导电性强弱
![]() 测定等物质的量浓度的
测定等物质的量浓度的![]() 和
和![]() 溶液的pH
溶液的pH
![]() 向
向![]() 和
和![]()
![]() 中加过量NaOH溶液
中加过量NaOH溶液
(3)冶炼金属铝时,用石墨做电极电解熔融______![]() 填化学式
填化学式![]() ,液态铝在______
,液态铝在______![]() 填“阴”或“阳”
填“阴”或“阳”![]() 极得到
极得到
(4)![]() 与
与![]() 在高温下反应可制得高温结构陶瓷氮化铝
在高温下反应可制得高温结构陶瓷氮化铝![]() ,且生成
,且生成![]() 。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为______
。NaN3晶体中阴、阳离子个数比为______,写出反应化学方程式为______
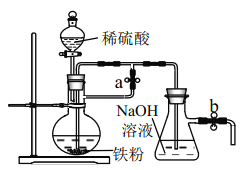
(5)聚合铝![]() 是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料
是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料![]() 主要成分为Al、
主要成分为Al、![]() 可制取聚合铝.实验步骤如下:
可制取聚合铝.实验步骤如下:

①写出酸溶过程中发生的非氧化还原反应的离子方程式:______
②聚合铝![]() 的分子式为
的分子式为![]() ,聚合铝中
,聚合铝中![]() 与
与![]() 的比值对净水效果有很大影响,定义盐基度
的比值对净水效果有很大影响,定义盐基度![]() :
:![]() ,当
,当![]() 时,
时,![]() ______
______![]() 填入合适数字
填入合适数字![]()
③制取聚合铝的方法有多种,若将步骤I后的溶液pH直接调制![]() 时,将在过程④发生聚合而得到某种聚合铝
时,将在过程④发生聚合而得到某种聚合铝![]() ,写出生成该聚合铝的离子反应方程式是______
,写出生成该聚合铝的离子反应方程式是______
【答案】![]() ,铝表面能形成致密的氧化膜,能保护内层金属不被氧化 c
,铝表面能形成致密的氧化膜,能保护内层金属不被氧化 c ![]() 阴 1:1
阴 1:1 
![]() 2
2 ![]()
【解析】
(1)铝的化学性质比较活泼,而铝在空气中稳定存在,是因表面生成致密的氧化膜;
(2)金属性强弱的判断方法有:置换氢气的难易程度、其最高价氧化物的水化物的碱性强弱、相同类型的盐的pH大小;
(3)工业上用石墨做电极电极熔融氧化铝制备金属铝,电解池中阴极发生还原反应;
(4)NaN3晶体中阴离子为N3-、阳离子为Na+,AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2.结合原子守恒配平书写化学方程式;
(5)①酸溶过程中发生的非氧化还原反应是氧化铝与盐酸反应生成氯化铝与水;
②B= 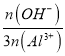 =
=![]() 时,则n(OH-)=2n(Al3+),由[Al2(OH)aClb]m可知a=4,再根据化合价代数和为0计算b的值;
时,则n(OH-)=2n(Al3+),由[Al2(OH)aClb]m可知a=4,再根据化合价代数和为0计算b的值;
③步骤I后的溶液为铝盐溶液,若将步骤I后的溶液pH直接调制4.2-4.5时,将在过程II发生聚合而得到某种聚合铝Alm(OH)nCl3m-n,结合原子守恒书写化学方程式。
(1)铝在空气中稳定存在,其原因是在常温下Al与氧气反应,铝表面能形成致密的氧化膜,能保护内层金属不被氧化,反应的化学方程式为:4Al+3O2=2Al2O3,故答案为:4Al+3O2=2Al2O3,铝表面能形成致密的氧化膜,能保护内层金属不被氧化;
(2)a.金属的导电性强弱不能证明金属的金属性强弱,故a错误;
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH,铝离子和镁离子浓度不同水解程度不同,不能证明金属活泼性,故b错误;
c.氢氧化镁不溶于氢氧化钠,而氢氧化铝能溶于氢氧化钠,说明氢氧化镁的碱性大于氢氧化铝,所以能比较两种金属的金属性强弱,故c正确;
故答案为:c;
(3)冶炼金属铝时,用石墨做电极电解熔融Al2O3,阴极上Al3++3e-=Al,故答案为:Al2O3,阴;
(4)NaN3晶体中阴离子为N3-、阳离子为Na+,晶体中阴、阳离子个数比为1:1,AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2.结合原子守恒配平书写化学方程式为:AlCl3+3NaN3 3NaCl+4N2↑+AlN,故答案为:1:1;AlCl3+3NaN3
3NaCl+4N2↑+AlN,故答案为:1:1;AlCl3+3NaN3 3NaCl+4N2↑+AlN;
3NaCl+4N2↑+AlN;
(5)①酸溶过程中发生的非氧化还原反应是氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为:Al2O3+6H+=2Al3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O;
②B== 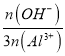 =
=![]() 时,则n(OH-)=2n(Al3+),由[Al2(OH)aClb]m可知a=4,根据化合价代数和为0有3×2+4×(-1)+b×(-1)=0,解得b=2,故答案为:2;
时,则n(OH-)=2n(Al3+),由[Al2(OH)aClb]m可知a=4,根据化合价代数和为0有3×2+4×(-1)+b×(-1)=0,解得b=2,故答案为:2;
③步骤I后的溶液为铝盐溶液,若将步骤I后的溶液pH直接调制4.2-4.5时,将在过程II发生聚合而得到某种聚合铝Alm(OH)nCl3m-n,结合原子守恒书写化学方程式为:nAl3++(3m-n)Cl-+nH2O=Alm(OH)nCl3m-n+nH+,故答案为:nAl3++(3m-n)Cl-+nH2O=Alm(OH)nCl3m-n+nH+。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】表1是元素周期表的一部分:
氧 | X |
Y | Z |
![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液分别滴定
的NaOH溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表
,实验数据如表
数据编号 | 滴入NaOH溶液的体积 | 溶液pH | |
HX | HZ | ||
① | 0 | 3 | 1 |
② | 20.00 | a | 7 |
下列判断正确的是
A.表格中![]()
B.HX和HZ等体积混合后![]()
C.Y和Z两元素的简单氢化物受热分解,前者分解温度高
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()