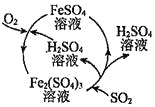
题目内容
【题目】一定温度下,恒容密闭容器内某一反应体系中M、N的物质的量随反应时间变化的曲线如右图所示,下列叙述正确的是( )

A. 该反应的化学方程式为2M![]() N
N
B. t1时N的浓度是M浓度的2倍
C. t2时正、逆反应速率相等,反应达到平衡状态
D. t3时正反应速率大于逆反应速率
【答案】B
【解析】A. 根据图像可知反应进行t2时N的物质的量减少8mol-4mol=4mol,N是反应物。M的物质的量增加4mol-2mol=2mol,M是生成物,变化量之比是化学计量数之比,因此该反应的化学方程式为2N![]() M,A错误;B. t1时N、M的物质的量分别是6mol、3mol,因此N的浓度是M浓度的2倍,B正确;C. t2时反应没有达到平衡状态,正、逆反应速率不相等,C错误;D. t3时反应达到平衡状态,正、逆反应速率相等,D错误,答案选B。
M,A错误;B. t1时N、M的物质的量分别是6mol、3mol,因此N的浓度是M浓度的2倍,B正确;C. t2时反应没有达到平衡状态,正、逆反应速率不相等,C错误;D. t3时反应达到平衡状态,正、逆反应速率相等,D错误,答案选B。

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
【题目】表1是元素周期表的一部分:
氧 | X |
Y | Z |
![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液分别滴定
的NaOH溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表
,实验数据如表
数据编号 | 滴入NaOH溶液的体积 | 溶液pH | |
HX | HZ | ||
① | 0 | 3 | 1 |
② | 20.00 | a | 7 |
下列判断正确的是
A.表格中![]()
B.HX和HZ等体积混合后![]()
C.Y和Z两元素的简单氢化物受热分解,前者分解温度高
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()