题目内容
10.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是ab(填字母)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据)①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
分析 (1)先根据溶液中电荷守恒计算氢离子的浓度,然后求出pH;
(2)二氧化硫使酸性氧化物和碱或碱性盐溶液反应;
(3)①计算出平衡时各种物质的物质的量,结合平衡常数的表达式计算;
②依据化学反应速率和平衡移动原理分析判断;
③根据G=△H-T•△S判断反应能否自发进行;
解答 解:(1)观察表格中发现NH4+水解显酸性,PM2.5的酸碱性为酸性;试样的pH值根据溶液中电荷守恒:c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)计算H+离子浓度为10-4,该样本的pH=4,
故答案为:酸性;4;
(2)洗涤含SO2的烟气,根据酸性氧化物的性质可选a.Ca(OH)2 b.Na2CO3,而氯化钙和亚硫酸氢钠不与二氧化硫反应,
故答案为:ab;
(3)①气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:吸热反应,温度升高,平衡正向移动,NO的含量增大;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T•△S,G>0,不能实现,
故答案为:)①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
点评 该题综合考查化学反应原理的基础知识,涉及离子的水解、pH值的计算、化学平衡常数的计算、自由能的应用等,题目难度中等,注意相关知识的积累.

练习册系列答案
相关题目
20.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 滴入甲基橙试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+、NH4+、ClO-、I- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、Ba2+、OH-、Cl- | |
| D. | 加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3- |
1.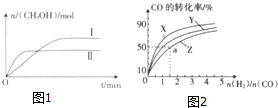 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,则:
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2,3mol H2 | 2mol CO2,6mol H2 |
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
18.下列过程中化学键没有被破坏的是( )
| A. | 水沸腾汽化 | B. | 水加热到1500℃开始分解 | ||
| C. | 熔融的氯化钠 | D. | NaOH溶于水 |
5.下列有关金属的说法正确的是( )
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 镁型和铜型的原子堆积方式空间利用率最高 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 温度升高,金属的导电性将变大 |
2.铝用来焊接钢轨是利用( )
| A. | 铝同氧气反应生成稳定的保护层 | B. | 铝是热的良导体 | ||
| C. | 铝是强还原剂,铝热反应放热 | D. | 铝合金强度大 |
19.下列过程中需要吸收热量的是( )
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | H2→2H | ||
| C. | CaO+H2O=Ca(OH)2 | D. | 2Cl→Cl2 |
20.X元素的一个原子失去两个电子转移到Y元素的两个原子中去,形成离子化合物Z,下列说法中错误的是( )
| A. | Z可以电离 | B. | Z可以表示为:XY2 | C. | X形成+2价阳离子 | D. | Z的电子式为 |
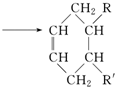 (可表示为
(可表示为 )其中,R、R′表示原子或原子团.
)其中,R、R′表示原子或原子团.
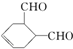 中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol
中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol .
.