题目内容
15.已知:CH2═CH-CH═CH2+R-CH═CH-R′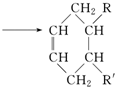 (可表示为
(可表示为 )其中,R、R′表示原子或原子团.
)其中,R、R′表示原子或原子团.A、B、C、D、E、F分别代表一种有机物,F的相对分子质量为278,其转化关系如下图所示(其他反应物、产物及反应条件略去):
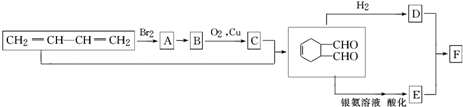
请回答下列问题:
(1)
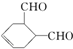 中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol
中官能团的名称是醛基.1mol该物质完全燃烧需消耗O26.5mol(2)A反应生成B需要的无机试剂是NaOH的水溶液.
(3)B与O2反应生成C的化学方程式为CH2OHCH=CHCH2OH+O2$→_{△}^{Cu}$OHCCH=CHCHO+2H2O.
(4)F的结构简式为
 .
.(5)写出含有“HC≡C-”和酯基、氧原子不与碳碳叁键直接相连、呈链状结构的C物质的一种同分异构体的结构简式:HC≡CCOOCH3或CH≡CCH2OOCH.
分析 根据流程图和所给信息,A为1,3-丁二烯和溴单质加成的产物,即A为CH2BrCH=CHCH2Br,B到C的转化醇被氧化为醛的反应,故B为CH2OHCH=CHCH2OH,C为OHCCH=CHCHO,据题目所给的信息反应转化后可推知E为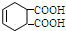 ,D为
,D为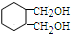 ,F为
,F为 ,
,
(1)根据官能团的名称来回答;据其分子式判断耗氧量多少;
(2)根据A到B的反应情况来确定所需要的试剂;
(3)根据伯醇能被氧气氧化为醛的化学性质来回答;
(4)根据物质之间的转化条件和性质来分析;
(5)根据同分异构题的书写方法来回答.
解答 解:(1)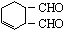 中含氧官能团是醛基,
中含氧官能团是醛基,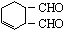 的分子式为C8H10O2,1molC8H10O2完全燃烧消耗氧气按从分子中去1个CO2剩余C7H10计算,为7+$\frac{10}{4}$=6.5mol,故答案为:醛基;6.5;
的分子式为C8H10O2,1molC8H10O2完全燃烧消耗氧气按从分子中去1个CO2剩余C7H10计算,为7+$\frac{10}{4}$=6.5mol,故答案为:醛基;6.5;
(2)从A到B的转化过程是将卤代烃转化为醇类,条件为:NaOH的水溶液,故答案为:NaOH的水溶液;
(3)B为CH2OHCH=CHCH2OH与O2反应的方程式为:CH2OHCH=CHCH2OH+O2$→_{△}^{Cu}$OHCCH=CHCHO+2H2O;
故答案为:CH2OHCH=CHCH2OH+O2$→_{△}^{Cu}$OHCCH=CHCHO+2H2O;
(4)F是 和
和 之间发生酯化反应后的产物,结构简式为:
之间发生酯化反应后的产物,结构简式为: ,故答案为:
,故答案为: ;
;
(5)C为OHCCH=CHCHO,符合条件的同分异构体有:HC≡CCOOCH3或CH≡CCH2OOCH,故答案为:HC≡CCOOCH3或CH≡CCH2OOCH.
点评 本题是一道有机框图推断题,考查了有机物的化学性质、官能团名称和有关化学反应类型的知识,难度较大.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
5.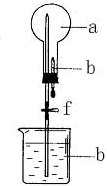 在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )
在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )
 在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )
在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b不满足题目要求的是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 4mol/LNaOH溶液 |
| C | Cl2 | 饱和NaOH溶液 |
| D | NH3 | 1mol/L盐酸 |
| A. | A | B. | B | C. | C | D. | D |
6.下列说法正确的是( )
| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 植物油和裂化汽油可用溴水鉴别 | |
| D. | 在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质 |
3.下列有关化学用语正确的是( )
| A. | 某元素基态原子的电子排布图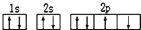 | |
| B. | NH4Cl电子式为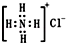 | |
| C. | Ca2+离子基态电子排布式为1s22s22p63s23p6 | |
| D. | 钾(K)的原子结构示意图为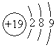 |
10.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是ab(填字母)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据)①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是ab(填字母)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据)①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
7.把纯碘化氢气体装入密闭容器中,它将按2HI?H2+I2反应进行分解(正反应吸热),当系统在趋向平衡状态的过程中,以下描述正确的是( )
| A. | 碘化氢的生成速率大于其分解速率 | B. | 碘化氢的生成速率等于其分解速率 | ||
| C. | 加催化剂不会影响达到平衡的时间 | D. | 升高温度可以加快平衡状态的到达 |
