题目内容
20.X元素的一个原子失去两个电子转移到Y元素的两个原子中去,形成离子化合物Z,下列说法中错误的是( )| A. | Z可以电离 | B. | Z可以表示为:XY2 | C. | X形成+2价阳离子 | D. | Z的电子式为 |
分析 元素X的一个原子失去2个电子并转移到元素Y的两个原子上,形成化合物Z,该反应是通过得失电子形成的化合物,所以Z为离子化合物,根据原子守恒确定Z的化学式为XY2,以此解答该题.
解答 解:元素X的一个原子失去2个电子并转移到元素Y的两个原子上,形成化合物Z,该反应是通过得失电子形成的化合物,所以Z为离子化合物,根据原子守恒确定Z的化学式为XY2,
A.Z为离子化合物,则Z可以电离,故A正确;
B.元素X的一个原子失去2个电子并转移到元素Y的两个原子上,形成化合物Z,根据原子守恒确定Z的化学式为XY2,故B正确;
C.元素X的一个原子失去2个电子,则X形成+2价阳离子,故C正确;
D.Z为离子化合物,其电子式为: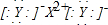 ,故D错误.
,故D错误.
故选D.
点评 本题考查了原子结构和元素的性质,根据得失电子确定化学键类型,再结合原子结构、物质构成分析解答,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
10.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是ab(填字母)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据)①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是ab(填字母)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据)①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
11.下列叙述中不正确的是( )
| A. | 常用铝盐溶液与氨水反应制取氢氧化铝 | |
| B. | 澄清石灰水盛装在用玻璃塞塞紧的试剂瓶中 | |
| C. | 氢气在氯气中燃烧产生苍白色火焰 | |
| D. | 新制氯水通常保存在棕色试剂瓶 |
8.能证明苯酚具有酸性的方法是( )
①苯酚溶液加热变澄清 ②苯酚浊液中加NaOH后,溶液变澄清,生成苯酚钠和水 ③苯酚可与FeCl3反应 ④在苯酚溶液中加入浓溴水产生白色沉淀 ⑤苯酚能与Na2CO3溶液反应.
①苯酚溶液加热变澄清 ②苯酚浊液中加NaOH后,溶液变澄清,生成苯酚钠和水 ③苯酚可与FeCl3反应 ④在苯酚溶液中加入浓溴水产生白色沉淀 ⑤苯酚能与Na2CO3溶液反应.
| A. | ③④ | B. | ①②⑤ | C. | ②⑤ | D. | ③④⑤ |
15.已知反应X+Y=M+N为放热反应,下列说法正确的是( )
| A. | X的能量不一定高于M的能量 | |
| B. | X和Y的总能量一定低于M和N的总能量 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | 此反应符合质量守恒,却不符合能量守恒 |
5.分别燃烧等物质的量的下列各组物质,其中消耗氧气量相等的是( )
①C2H2 与CH3CHO ②C7H8与C6H12 ③C2H2与C6H6④HCOOCH3与CH3COOH.
①C2H2 与CH3CHO ②C7H8与C6H12 ③C2H2与C6H6④HCOOCH3与CH3COOH.
| A. | ①②③④ | B. | ①②④ | C. | ①④ | D. | ②④ |
12.下列反应的离子方程式正确的是( )
| A. | NaHCO3溶液与盐酸:CO32-+2 H+=H2O+CO2↑ | |
| B. | 硝酸银溶液与铜:Cu+Ag+=Cu2++Ag | |
| C. | 金属钾与水反应:K+H2O═K++OH-+H2↑ | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑ |
3.化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺.化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护.在ABS工程塑料表面进行化学镀镍的流程如下:

回答下列问题:
(1)化学镀与电镀比较,优点之一是不需通电.
(2)镀件表面用热碱液清洗的作用是除去镀件表面油污,镀件表面粗化的目的是增强亲水性及增大接触面积.
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4.
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3.
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如表所示:
由此推断,镀层厚度y与反应时间t的关系式为y=at1/2;欲使镀层厚度为6anm,需要的反应时间为36s.
(6)化学镀镍废液中含有Ni 2+等污染物,需转化为沉淀除去.已知25℃,Ksp[Ni(OH)2]=2.0×10-15.若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为1.2×10-2mg•L-1.

回答下列问题:
(1)化学镀与电镀比较,优点之一是不需通电.
(2)镀件表面用热碱液清洗的作用是除去镀件表面油污,镀件表面粗化的目的是增强亲水性及增大接触面积.
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是2SnCl2+4AgNO3═4Ag+SnCl4+Sn(NO3)4.
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是2H2O+Ni2++2H2PO2-=Ni++H2↑+2H3PO3.
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如表所示:
| 反应时间t/s | 1 | 4 | 9 | 16 |
| 镀层厚度y/nm | a | 2a | 3a | 4a |
(6)化学镀镍废液中含有Ni 2+等污染物,需转化为沉淀除去.已知25℃,Ksp[Ni(OH)2]=2.0×10-15.若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为1.2×10-2mg•L-1.