题目内容
1.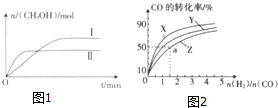 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2,3mol H2 | 2mol CO2,6mol H2 |
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
分析 (1)II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,温度越高,化学平衡常数越小;
(2)①该反应为气体体积减小的反应,体积相同,乙中各反应物的起始物质的量是甲的2倍,压强乙大于甲,据此判断;
②根据甲中平衡后气体的压强为开始的0.8倍,可计算得甲中平衡时CH3OH(g)的浓度,乙中CH3OH(g)的浓度大于甲中两倍,据此判断;
(3)根据正逆反应速率相等,组成成分不变,以及反应前后气体体积变化的可逆反应中的压强等判断反应是否平衡;
(4)化学平衡常数等于生成物浓度的系数次幂之积除以反应物浓度的系数次幂之积,该反应是放热反应,根据温度对平衡的影响判断曲线;可逆反应不能完全正向进行,据此判断反应热.
解答 解:(1)II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ,
故答案为:>;
(2)①该反应为气体体积减小的反应,体积相同,乙中各反应物的起始物质的量是甲的2倍,压强乙大于甲,所以反应乙正向进行的程度大于反应甲,所以P乙<2p甲,
故选c;
②在甲容器中,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
起始(mol) 1 3 0 0
转化(mol) x 3x x x
平衡(mol) 1-x 3-3x x x
根据甲中平衡后气体的压强为开始的0.8倍,可得 1-x+3-3x+x+x=0.8×(3+1),x=0.4,所以CH3OH的物质的量为0.4mol,乙中的压强大于甲,平衡向正反应方向移动,且乙的起始物质的量是甲的两倍,所以乙中CH3OH(g)的浓度大于甲中两倍,
故选b;
(3)a.此反应若在恒压容器中进行,所以当容器中压强不变时,所以不能说明反应处于平衡状态;
b.H2的体积分数不变时,反应处于平衡状态;
c.c(H2)=3c(CH3OH),未说明是正反应还是逆反应,所以不能说明反应处于平衡状态;
d.此反应若在恒压容器中进行,反应前后容器体积发生变化,气体质量不变,所以容器中密度不变时,说明反应处于平衡状态;
e.2个C=O断裂的同时有3个H-H断裂,都是指的正反应速率,所以不能说明反应处于平衡状态;
故选bd;
根据正逆反应速率相等,组成成分不变,以及反应前后气体体积变化的可逆反应中的压强等判断反应是否平衡;
(4)化学平衡常数等于生成物浓度的系数次幂之积除以反应物浓度的系数次幂之积,根据CO(g)+2H2(g)?CH3OH(g)可得K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$,该反应是放热反应,升高温度平衡逆向移动,CO的转化率下降,Z线对应的CO的转化率最低,所以对应的温度为270℃,可逆反应不能完全正向进行,所以1molCO反应放出的热量最多为90.8kJ,
故答案为:$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;270℃;90.8.
点评 本题综合性考查了影响平衡移动的因素、平衡常数的表达式及平衡状态的判断等,侧重于对基础知识的综合应用的考查,题目难度中等,侧重于考查学生的分析能力和解决问题的能力.

 习题精选系列答案
习题精选系列答案| A. | 氢有三种核素:H、D、T | B. | S2-的结构示意图: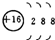 | ||
| C. | 石英中存在SiO2分子 | D. | CO2分子的结构式:O=C=O |
| A. | 18.8g苯酚中含有碳碳双键的个数为0.6NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 标准状况下,11.2L 三氯甲烷所含分子数为0.5NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 植物油和裂化汽油可用溴水鉴别 | |
| D. | 在鸡蛋白溶液中加入浓HNO3,微热后会生成黄色物质 |
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是ab(填字母)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据)①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
| A. | 常用铝盐溶液与氨水反应制取氢氧化铝 | |
| B. | 澄清石灰水盛装在用玻璃塞塞紧的试剂瓶中 | |
| C. | 氢气在氯气中燃烧产生苍白色火焰 | |
| D. | 新制氯水通常保存在棕色试剂瓶 |
 在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断
在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: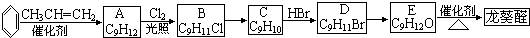
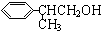 +O2
+O2
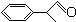 +2H2O.
+2H2O. 、
、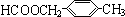 .
.