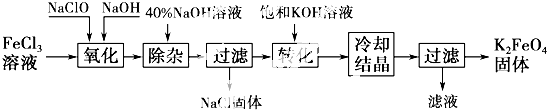
题目内容
19.氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点.(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(2)现有反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| 物质的量 | CO | H2 O | CO2 | H2 |
| 甲 | a mol | a mol | 0mol | 0mol |
| 乙 | 0mol | 0mol | 2a mol | a mol |
| 丙 | 0mol | 0mol | a mol | a mol |
| 丁 | a mol | a mol | a mol | a mol |
(3)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3得金属钨,总反应为WO3 (s)+3H2 (g)$\stackrel{高温}{?}$W (s)+3H2O (g).请回答下列问题:
①某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%.
②上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
③钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g)$?_{3000℃}^{1400℃}$ WI4 (g).下列说法正确的有AB(填字母).
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
分析 (1)上述反应过程中能量转化形式为光能转化为化学能,达平衡时,生成氧气0.002mol,根据热化学方程式计算;
(2)在相同温度和压强下的可逆反应,反应后气体体积不变,按方程式的化学计量关系转化为方程式同一边的物质进行分析,判断是否等效平衡;
(3)①由反应方程式知,消耗的H2与生成的水的物质的量相等,假定H2与水蒸气的物质的量分别为2mol、3mol,再根据转化率定义计算;
②根据三个阶段的方程式进行计算三个阶段消耗H2物质的量之比;
③由化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W附着在还没有挥发的W上,灯管壁温度较低,WI4不会分解,升高温度,正逆反应速率都加快,据此解答.
解答 解:(1)上述反应过程中能量转化形式为光能转化为化学能,达平衡时,生成氧气0.002mol,至少需要吸收的光能为0.002mol×484kJ•mol-1=0.968kJ,
故答案为:化学;0.968;
(2)该反应是一个气体体积不变的反应,等效平衡条件是采用“一边倒”方法转化后对应物质成比例即可.
对乙、丙和丁进行“一边倒”转化,
假设乙、丙、丁中的CO、H2O(g)全部转化为CO2、H2,再与甲、乙比较:
CO(g)+H2O(g)?CO2(g)+H2(g)
乙开始时 0mol 0mol 2amol amol
乙假设全转化 amol amol amol 0mol
丙开始时 0mol 0mol amol amol
丙假设全转化 amol amol 0mol 0mol
丁开始时 amol amol amol amol
丁假设全转化 2amol 2amol 0mol 0mol
经转化后,甲、丙的起始浓度一样,乙相对于甲在增加CO2的物质的量,使平衡逆向移动,因此乙平衡时的CO物质的量比甲、丙大;而丁相对于乙在增加氢气的物质的量,使平衡逆向移动,因此丁平衡时的CO物质的量比乙大,所以甲、乙、丙、丁容器中n(CO)的大小顺序为丁>乙>甲=丙;
故选:丁>乙>甲=丙;
(3)①由反应方程式知,消耗的H2与生成的水的物质的量相等,故H2的平衡转化率$\frac{3mol}{2mol+3mol}$×100%=60%,故答案为:60%;
②假定有2molWO3,由2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W25+H2O、W2O5+H2$\frac{\underline{\;高温\;}}{\;}$2WO2+H2O、WO2+2H2$\frac{\underline{\;高温\;}}{\;}$W+2H2O可知,三个阶段消耗的氢气的物质的量之比为1mol:1mol:2mol×2=1:1:4,
故答案为:1:1:4;
③由所给化学方程式知,挥发的W与I2结合形成气态WI4,由于气体运动的结果,WI4会与还没有挥发的W接触,在高温下WI4分解生成的W及I2,生成W附着在还没有挥发的W上,灯管内的I2可循环使用,故AB对;灯管壁温度较低,WI4不会分解,故C错;升高温度,也能加快W与I2的反应速率,故D错,
故答案为:AB.
点评 本题考查化学反应与能量变化、化学平衡移动原理、化学平衡计算等,题目选择的素材比较陌生,以考查学生的能力为主,难度中等.

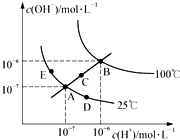
| A. | 图中五点的KW间的关系为:B>C>A=D=E | |
| B. | 若从A点到D点,可采用:恒温条件下,在水中加入少量的醋酸,提高溶液酸性 | |
| C. | 若从A点到C点,可采用:恒温条件下,在水中加入少量的醋酸铵,促进水的电离 | |
| D. | 100℃时,将pH=2的硫酸与0.01mol•L-1的KOH溶液等体积混合后,溶液中c(H+)=c(OH-)=10-6mol•L-1 |
| A. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| B. | 将煤气化后再作为能源,可减少PM2.5引起的危害 | |
| C. | 石英用于生产光导纤维和计算机芯片 | |
| D. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 |
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 对N2+3H2═2NH3的反应,使用铁触媒可加快合成氨反应的速率 | |
| C. | 工业制取金属钾Na(l)+KCl(l)═NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 氯水中存在如下平衡:Cl2+H2O═HCl+HClO,当加入NaOH溶液后颜色变浅 |
| A. | 如果没有试管夹,可以临时手持试管给固体或液体加热 | |
| B. | 酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭扑灭,不能用水泼灭 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 | |
| D. | 少量浓硫酸沾到皮肤上时,可立即用大量水冲洗,然后涂上20%~30%的NaOH溶液 |
| A. | Al2(SO4)3═3Al3++2SO42- | B. | AlCl3═Al3++Cl3- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | KMnO4═K++Mn2++4O2- |