题目内容
10.等体积的下列溶液中,阳离子的总物质的量最大的是①(填序号).①0.2mol•L-1的CuSO4溶液 ②0.1mol•L-1的Na2CO3
③0.2mol•L-1的KCl ④0.1mol•L-1的Na2SO4.
分析 物质的量n=cV,各选项中若阳离子不水解,由于阳离子浓度、溶液的体积相等,则含有的阳离子的物质的量相等;然后根据溶液中离子的水解情况进行分析.
解答 解:①溶液中铜离子水解时生成氢离子,导致阳离子的浓度大于2mol/L;
②0.1mol•L-1的Na2CO3溶液中碳酸根离子水解需要氢离子,阳离子浓度大于2mol/L,但小于硫酸铜溶液中阳离子的物质的量;
③0.2mol•L-1的KCl溶液中钾离子不水解,阳离子浓度接近2mol/L;
④0.1mol•L-1的Na2SO4溶液中钠离子不水解,阳离子浓度接近2mol/L;
所以阳离子物质的量最大的是①,
故答案为:①.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
1.能将Al2(SO4)3、(NH4)2SO4、KCl、MgCl2、FeCl2、Fe2(SO4)3六种溶液鉴别出来的一种试剂是( )
| A. | NaOH溶液 | B. | KSCN溶液 | C. | AgNO3溶液 | D. | BaCl2溶液 |
5.下列实验操作正确的是( )
| A. | 用苯萃取溴水中的溴时,应将溴的苯溶液从分液漏斗下口放出 | |
| B. | 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏小 | |
| C. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后,与标准比色卡比较 | |
| D. | 蒸发操作时,蒸发皿必须放在石棉网上,并用酒精灯的外焰加热 |
2.体积相同的HCl、H2SO4、H3PO4被NaOH溶液中和时,消耗相同物质的量浓度的NaOH溶液,体积比依次为3:2:1,则三种酸的物质的量浓度之比为( )
| A. | 3:2:1 | B. | 6:3:2 | C. | 9:3:1 | D. | 12:6:5 |
19.氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点.
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
上述反应过程中能量转化形式为光能转化为化学能,达平衡过程中至少需要吸收光能为0.968kJ.
(2)现有反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
上述四种情况达到平衡后,甲、乙、丙、丁容器中n(CO)的大小顺序为丁>乙>甲=丙.
(3)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3得金属钨,总反应为WO3 (s)+3H2 (g)$\stackrel{高温}{?}$W (s)+3H2O (g).请回答下列问题:
①某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%.
②上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
③钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g)$?_{3000℃}^{1400℃}$ WI4 (g).下列说法正确的有AB(填字母).
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H=+484kJ•mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
(2)现有反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在相同温度和相同体积下进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| 物质的量 | CO | H2 O | CO2 | H2 |
| 甲 | a mol | a mol | 0mol | 0mol |
| 乙 | 0mol | 0mol | 2a mol | a mol |
| 丙 | 0mol | 0mol | a mol | a mol |
| 丁 | a mol | a mol | a mol | a mol |
(3)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3得金属钨,总反应为WO3 (s)+3H2 (g)$\stackrel{高温}{?}$W (s)+3H2O (g).请回答下列问题:
①某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%.
②上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
③钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W(s)+2I2 (g)$?_{3000℃}^{1400℃}$ WI4 (g).下列说法正确的有AB(填字母).
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
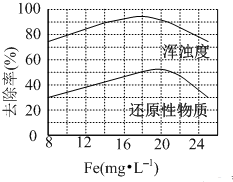 FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题: