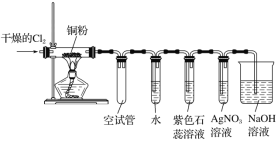
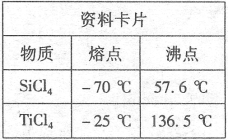
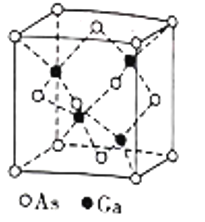
题目内容
【题目】某结晶水合物分子式为RnH2O,其相对分子质量为M,25℃时,a g晶体溶于b g水中即饱和,形成V ml密度为ρ g/cm3的溶液,下列不正确的是 ( )
A. 饱和溶液的质量分数为![]() B. 25℃,R的溶解度为
B. 25℃,R的溶解度为![]() g
g
C. 饱和溶液的质量分数为![]() D. 饱和溶液物质的量浓度为
D. 饱和溶液物质的量浓度为![]() mol/L
mol/L
【答案】B
【解析】
晶体的物质的量为a/M mol,溶质的质量为a(M-18n)/M g;溶液的质量为(a+b)g 或ρV g,溶液的体积为V mL,
A. 溶质的质量为(a-a×18n/M)g,溶液质量ρV g;所以饱和溶液的质量分数为(a-a×18n/M)÷ρV×100%=a(M-18n)/ρV×100%=![]() ,故A正确;
,故A正确;
B.设25℃时,A的溶解度为S,则S/(100+S)= [a(M-18n)/M]/(a+b),R的溶解度为:S=100a(M-18n)/(bM+18an),故B错误;
C. 溶质的质量为(a-a×18n/M)g,溶液质量为(a+b)g;所以饱和溶液的质量分数为=(a-a×18n/M)÷(a+b)×100%=![]() ,故C正确;
,故C正确;
D.晶体的物质的量为a/M mol,则溶质的物质的量为a/M mol,溶液的体积为V mL=V×10-3L;根据c=n/V可知,饱和溶液物质的量浓度为=(a/M)÷(V×10-3)=![]() mol/L,故D正确;
mol/L,故D正确;
故答案选B。

【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分(C、D中溶液成份均过量)。
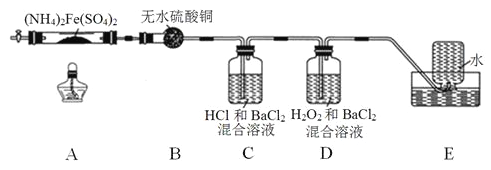
(1)B装置的作用是______________________________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有__________气体产生,写出D中发生反应的离子方程式___________________________________。若去掉C,是否能得出同样结论并解释其原因__________________________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解,平均分成2份;_____ | _________________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为___________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式_____________________________。