题目内容
【题目】(1)21世纪是钛的世界,钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。工业上二氧化钛的制备是:
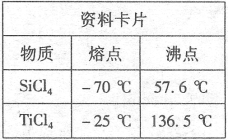
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4,所采取的操作名称是_______
III.用TiCl4制备TiO2·xH2O的化学方程式为________________,制备时需要________,促进水解趋于完全。
IV.TiO2·xH2O高温分解得到TiO2。如在实验室中进行,则需在________(填仪器名称)中加热。
(2)亚硫酰氯(SOCl2)是一种液态化合物,沸点为77℃,在农药制药等领域用途广泛。SOCl2遇水剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出,该气体可使品红溶液褪色。根据上述实验,写出SOCl2与水反应的化学方程式_________________________________________________,AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得无水AlCl3,其原因是______________________________
【答案】蒸馏 TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl 加大量的水同时加热 坩埚 SOCl2+H2O=SO2↑+2HCl SOCl2与水反应既减少了水的量,生成的HCl又抑制了AlCl3的水解。
TiO2·xH2O↓+4HCl 加大量的水同时加热 坩埚 SOCl2+H2O=SO2↑+2HCl SOCl2与水反应既减少了水的量,生成的HCl又抑制了AlCl3的水解。
【解析】
(1)Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,发生反应生成氯化钛、CO,因为金红石中含有二氧化硅,所以制得混有SiCl4杂质的TiCl4;
Ⅱ.四氯化钛和四氯化硅熔沸点差别较小,可以采用蒸馏方法将SiCl4分离,得到纯净的TiCl4;
Ⅲ.向TiCl4中加水,加热,四氯化钛水解得到沉淀TiO2·xH2O,同时生成HCl;
Ⅳ.将TiO2·xH2O高温分解得到TiO2和水,高温分解固体物质,通常在坩埚中进行。
(2) SOCl2和水剧烈反应,液面上有白雾生成,说明生成的气体遇水蒸气能形成小液滴,说明生成的白雾是稀盐酸,则气体中含有HCl;还生成气体,该气体能使品红溶液褪色说明该气体具有漂白性,根据元素守恒知,生成物中含有二氧化硫;
氯化铝易水解生成氢氧化铝和稀盐酸,盐酸具有挥发性,加热促进氯化铝水解,蒸干时得到的固体是氢氧化铝,灼烧氢氧化铝,氢氧化铝分解生成氧化铝和水,所以灼烧得到的固体是氧化铝,SOCl2和水剧烈反应生成HCl而抑制铝离子水解。
(1)Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合放入氧化炉中,在高温下通入Cl2反应,发生反应生成氯化钛、CO,因为金红石中含有二氧化硅,所以制得混有SiCl4杂质的TiCl4;
Ⅱ.根据表中数据知,四氯化钛和四氯化硅在常温下都是液态,且二者熔沸点差别较小,可以采用蒸馏方法分离,
因此,本题正确答案是:蒸馏;
Ⅲ.向TiCl4中加水,加热,四氯化钛水解得到沉淀TiO2·xH2O,同时生成HCl,反应方程式为TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl;制备时需要加大量的水同时加热促进水解趋于完全。
TiO2·xH2O↓+4HCl;制备时需要加大量的水同时加热促进水解趋于完全。
因此,本题正确答案是:TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl;加大量的水同时加热;
TiO2·xH2O↓+4HCl;加大量的水同时加热;
Ⅳ.将TiO2·xH2O高温分解得到TiO2和水,高温分解固体物质,通常在坩埚中进行,
因此,本题正确答案是:坩埚。
(2) SOCl2和水剧烈反应,液面上有白雾生成,说明生成的气体遇水蒸气能形成小液滴,说明生成的白雾是稀盐酸,则气体中含有HCl;还生成气体,该气体能使品红溶液褪色说明该气体具有漂白性,根据元素守恒知,生成物中含有二氧化硫,所以该反应方程式为SOCl2+H2O=SO2↑+2HCl,
因此,本题正确答案是:SOCl2+H2O=SO2↑+2HCl;
氯化铝易水解生成氢氧化铝和稀盐酸,盐酸具有挥发性,加热促进氯化铝水解,蒸干时得到的固体是氢氧化铝,灼烧氢氧化铝,氢氧化铝分解生成氧化铝和水,所以灼烧得到的固体是氧化铝,SOCl2和水剧烈反应生成HCl而抑制铝离子水解,且SOCl2与水反应既减少了水的量,所以能得到氯化铝固体,
因此,本题正确答案是:SOCl2与水反应既减少了水的量,生成的HCl又抑制了AlCl3的水解。

【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。