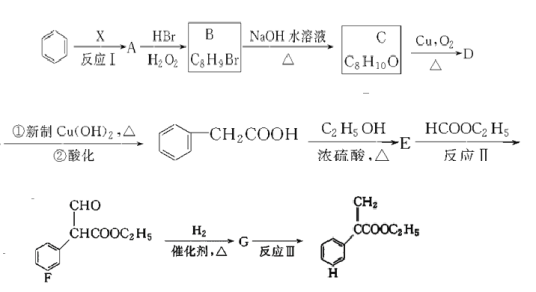
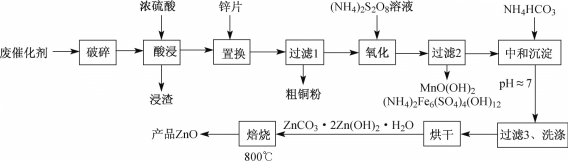
题目内容
【题目】硼、铝、镓、铟、铊是第ⅢA族元素,它们在工农业生产中应用非常广泛。
(1)基态硼原子的核外电子排布图为______________________。
(2)I1(Mg)___________I1(Al)(填“大于”或“小于”),其原因是______________________。
(3)三氯化铝加热到177.8℃时,会升华为气态二聚氯化铝(Al2Cl6,其中铝原子和氯原子均达8电子稳定结构),请写出二聚氯化铝(Al2Ci6)的结构式:______________________,其中铝原子轨道采用___________杂化。
(4)BF4-的空间构型为___________,与BF4-互为等电子体的分子是___________ (写化学式,任写一种即可)。
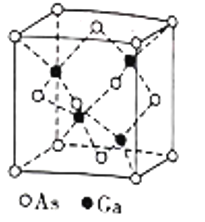
(5)镓(Ga)可与砷(As)形成砷化(GaAs)晶体,该晶体的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,阿伏加德罗常数值为NA,则晶胞中Ca与As原子的核间距为___________pm。(列出字母表达式)
【答案】![]() 大于 价层电子排布式为3s2,3s轨道为全满结构,Al原子的价层电子排布式为3s2p1,其3p上的1个电子较易失去
大于 价层电子排布式为3s2,3s轨道为全满结构,Al原子的价层电子排布式为3s2p1,其3p上的1个电子较易失去 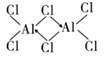 sp3 正四面体形 CCl4 原子晶体
sp3 正四面体形 CCl4 原子晶体 ![]()
【解析】
(1)B原子核外有5个电子,核外电子排布式为1S22S22P1;
(2)Mg原子的3s轨道为全满结构;
(3)氯化铝为分子晶体,二聚氯化铝分子中Cl原子与2个Al原子形成的化学键中有1个是配位键;
(4)BF4-中B原子的价层电子对数4,孤对电子数为0,与BF4-互为等电子体的分子应有5个原子、价电子数为32;
(5)GaAs是以共价键结合形成属于原子晶体,晶胞中有4个GaAs,由质量公式计算晶胞中Ca与As原子的核间距。
(1)B原子核外有5个电子,根据构造原理可知基态B原子核外电子排布式为1S22S22P1,核外电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)Mg原子的价层电子排布式为3s2,3s轨道为全满结构,Al原子的价层电子排布式为3s2p1,其3p上的1个电子较易失去形成全满稳定结构,故答案为:大于;因为价层电子排布式为3s2,3s轨道为全满结构,Al原子的价层电子排布式为3s2p1,其3p上的1个电子较易失去;
(3)氯化铝易升华说明其为分子晶体,由二聚氯化铝的分子式为Al2Ci6可知Cl原子最外层有7个电子,只能与Al原子各提供1个电子形成一个共价键,使自己达到8电子稳定结构,Al原子最外层有3个电子,可分别与3个Cl原子形成共价键,因而Cl原子与2个Al原子形成的化学键中,必有1个是配位键,由于电子对由Cl原子提供,这样Cl原子最外层电子数仍为8,Al原子最外层也成为8电子结构,二聚氯化铝的结构式为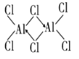 ;铝原子连有四个氯原子,说明铝原子轨道采用sp3杂化,故答案为:
;铝原子连有四个氯原子,说明铝原子轨道采用sp3杂化,故答案为: ;sp3;
;sp3;
(4)BF4-中B原子的价层电子对数4,孤对电子数为0,空间构型为正四面体形;CCl4与BF4-原子个数相同、价电子数相同,互为等电子体,故答案为:正四面体;CCl4;
(5)GaAs的熔点为1238℃,熔点较高,以共价键结合形成属于原子晶体,密度为ρgcm-3,由晶胞结构可知晶胞中As原子个数为8×1/8+6×1/2=4,Ga原子个数为4×1=4,晶胞的质量为![]() g,设晶胞中Ca与As原子的核间距为xcm,则晶胞的边长为
g,设晶胞中Ca与As原子的核间距为xcm,则晶胞的边长为![]() x,体积为(
x,体积为(![]() x)3,质量为(
x)3,质量为(![]() x)3ρ,由质量关系可得:(
x)3ρ,由质量关系可得:(![]() x)3ρ=
x)3ρ=![]() ,则x=
,则x=![]() ×1010pm,故答案为:原子晶体;
×1010pm,故答案为:原子晶体;![]() ×1010。
×1010。

【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566 kJ/mol
S(l)+O2(g)=SO2(g) ΔH2=-296 kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 在1 L 的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 ,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g) 在1 L 的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 ,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
①反应进行到4 min 时,v(正)____ (填“>”“<”或“=”)v(逆)。0~4 min,H2的平均反应速率v(H2)=____________mol·L-1·min-1。

②CO2平衡时的体积分数为_______________,该温度下Kp为__________(用含有p0的式子表示)。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1 mol CO2,3 mol H2 | 0.5 mol CO2,1 mol H2 1 mol CH3OH,1 mol H2O |
CH3OH的平衡浓度/mol·L-1 | C1 | C2 |
则乙容器中反应起始向________方向进行;c1_________(填“>”“<”或“=”)c2。
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。
【题目】“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究氰化物的性质:已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
25℃电离平衡常数 | Ki=1.77×10﹣4 | Ki=5.0×10﹣10 | Ki1=4.3×10﹣7 Ki2=5.6×10﹣11 |
(1)NaCN溶液呈碱性的原因是________________________ (用离子方程式表示)
(2)如图表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是_________

A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN﹣)>c(HCOO﹣)>c(OH﹣)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN﹣+CO2+H2O=HCN+CO32﹣
C.图像中a点酸的总浓度小于b点酸的总浓度
D.c点溶液的导电性比a点溶液的导电性弱
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为_____。
(4)下列四种离子结合H+能力由弱到强的是______________________________________。
A. HCOO- B. CN- C. CO32- D.HCO3-