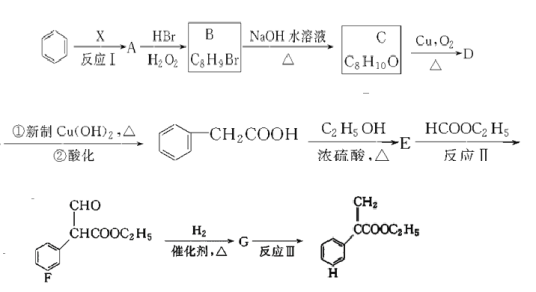
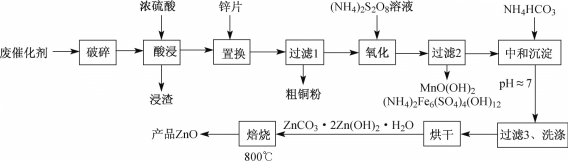
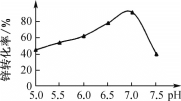
题目内容
【题目】肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A. N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B. 铂做电极,以KOH溶液为电解质的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
C. 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O![]() N2H5+ + OH-
N2H5+ + OH-
D. 2NO2![]() N2O4,加压时颜色加深,可以用勒夏特列原理解释
N2O4,加压时颜色加深,可以用勒夏特列原理解释
【答案】B
【解析】
A、根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数,进行相应的加减。
B、原电池总反应为N2H4 + O2= N2+ 2H2O,原电池正极发生还原反应,氧气在正极放电,碱性条件下,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极电极反应式;
C、肼是与氨类似的弱碱,N2H4不是电解质,N2H4![]() H2O弱电解质,N2H4
H2O弱电解质,N2H4![]() H2O存在电离平衡,电离出N2H5+ 、OH-;
H2O存在电离平衡,电离出N2H5+ 、OH-;
D、可逆反应2NO2![]() N2O4,正反应为体积缩小的反应,加压后平衡向正反应方向移动,与颜色变深相矛盾,以此解答。
N2O4,正反应为体积缩小的反应,加压后平衡向正反应方向移动,与颜色变深相矛盾,以此解答。
A、已知:①N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol;
由盖斯定律,①+②得
2N2H4(g) + 2O2(g) = 2N2(g) + 4H2O(g) ΔH =67.7kJ/mol-1135.7kJ/mol=-1068 kJ/mol,
即N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -534kJ/mol,故A错误;
B、原电池总反应为N2H4 + O2= N2+ 2H2O,原电池正极发生还原反应,氧气在正极放电,碱性条件下,正极电极反应式为O2+2H2O+4e-=4OH-,总反应式减去正极反应式可得负极电极反应式为N2H4 -4e- + 4OH- = N2 + 4H2O,所以B选项是正确的;
C、肼是与氨类似的弱碱,N2H4不是电解质,N2H4![]() H2O弱电解质,N2H4
H2O弱电解质,N2H4![]() H2O存在电离平衡,电离方程式为N2H4 + H2ON2H5+ + OH-,故B错误;
H2O存在电离平衡,电离方程式为N2H4 + H2ON2H5+ + OH-,故B错误;
D、可逆反应2NO2![]() N2O4,正反应为体积缩小的反应,加压后平衡向正反应方向移动,气体颜色应变浅,而颜色加深是因为加压后体积减小,NO2浓度增大,与平衡移动无关,所以不能用平衡移动原理解释,故D错误。
N2O4,正反应为体积缩小的反应,加压后平衡向正反应方向移动,气体颜色应变浅,而颜色加深是因为加压后体积减小,NO2浓度增大,与平衡移动无关,所以不能用平衡移动原理解释,故D错误。
所以B选项是正确的。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案