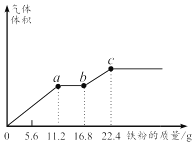
题目内容
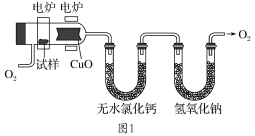
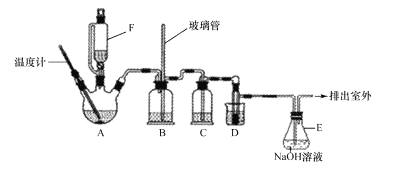
【题目】某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。
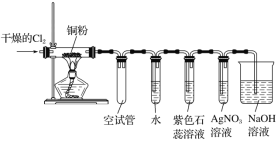
已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为____。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中生成白色沉淀的化学方程式:____。
(3)硬质玻璃管中的反应现象为__,反应的化学方程式为___。
(4)装置中空试管的作用是____。
(5)烧杯中氢氧化钠溶液的作用是___,发生反应的化学方程式为____。
【答案】通入氯气排尽装置中的空气 Cl2+H2O=HCl+HClO、HCl+AgNO3=AgCl↓+HNO3 剧烈反应,产生棕黄色的烟 Cu+Cl2![]() CuCl2 防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂 吸收尾气中的氯气,防止污染空气 Cl2+2NaOH=NaCl+NaClO+H2O
CuCl2 防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂 吸收尾气中的氯气,防止污染空气 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)铜容易被空气中氧气反应,因此装置中必须排除空气;
(2)氯气溶于水会生成盐酸与次氯酸,其中盐酸与硝酸银会反应生成氯化银白色沉淀,据此分析书写涉及的化学方程式;
(3)根据铜与氯气反应生成氯化铜的实验现象分析作答,注意颜色变化;
(4)干燥的氯气与铜粉在加热的条件下反应,若有水蒸气进入发生装置可能会发生试管炸裂,据此分析空试管的作用;
(5)氯气有毒,需用碱液吸收。
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作应该为:通入氯气排尽装置中的空气;
(2)氯水中存在氯离子,能与银离子反应生成氯化银,故白色沉淀为氯化银,反应的化学方程式为:Cl2+H2O=HCl+HClO;HCl+AgNO3=AgCl↓+HNO3;
(3)干燥的氯气与铜粉在高温下剧烈反应生成氯化铜,产生棕黄色的烟,化学方程式为:Cu+Cl2![]() CuCl2,故答案为:剧烈反应,产生棕黄色的烟;Cu+Cl2
CuCl2,故答案为:剧烈反应,产生棕黄色的烟;Cu+Cl2![]() CuCl2;
CuCl2;
(4)空试管的作用是:防止右侧试管中的水倒吸入硬质玻璃管中,使硬质玻璃管炸裂;
(5)氢氧化钠溶液可吸收尾气中的氯气,防止污染空气,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:吸收尾气中的氯气,防止污染空气;Cl2+2NaOH=NaCl+NaClO+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。