题目内容
18.海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-HCO3-等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.Ⅰ火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
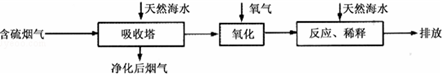
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2═2H2SO4;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为SO2+NH3•H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3.H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
Ⅱ重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶 电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
( 7 )如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol/L,问该工厂处理后的废水中c(Ag+)=9×10-9 mol•L-1.(已知KSP(AgCl)=1.8×10-10)
分析 Ⅰ、(1)根据海水中的离子是否水解进行解答;
(2)根据使用空气中的氧气将H2SO3氧化来分析;利用酸碱反应分析混合的目的;
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,结合溶液中电荷守恒分析;
(4)相同物质的量的SO2与NH3溶于水反应生成亚硫酸氢铵;结合溶液中电荷守恒和物料守恒分析判断选项;
Ⅱ、(5)由表格中的数据可知,溶度积越小的越易转化为沉淀;
(6)根据Pb(OH)2的溶度积进行计算;
(7)根据氯化银的溶度积进行解答,并与排放标准对比来说明是否符合排放标准.
解答 解:Ⅰ.(1)海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO-3等离子,在这些离子中能发生水解的是CO32-、HCO-3离子,CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,
故答案为:CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-;
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,氧气将H2SO3氧化为硫酸,该反应为2H2SO3+O2=2H2SO4,氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2═2H2SO4;
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,溶液中存在电荷守恒c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到c(Na+)=2c(SO32-)+c(HSO3-),
故答案为:2c(SO32-)+c(HSO3-);
(4)相同物质的量的SO2与NH3溶于水发生反应生成碳酸氢铵,反应的离子方程式为SO2+NH3+H2O═NH4++HSO3-,溶液中存在电荷守恒:c(HSO3-)+2c(SO32-)+c(OH-)=c(H+)+c(NH4+),c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+),D正确,C错误;溶液中存在物料守恒:c(NH4+)+c(NH3•H2O)=c(HSO3-)+c(SO32-)+c(H2SO3),结合电荷守恒和物料守恒可知c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+)=c(SO32-)+c(NH3.H2O)-c(H2SO3),所以A错误,B正确;
故答案为:SO2+NH3+H2O═NH4++HSO3-;BD;
Ⅱ.(5)由表格中的数据可知,溶度积越小的越易转化为沉淀,显然只有硫化物的溶度积小,则应选择硫化钠,
故答案为:B;
(6)由Pb(OH)2的溶度积为1.2×10-15,pH=8.0,c(OH-)=10-6mol•L-1,则c(Pb2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=1.2×10-3mol•L-1,
故答案为:1.2×10-3mol•L-1;
(7)废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1),c(Cl-)=c(NaCl)=$\frac{1000×1g/ml×0.117%}{58.5g/mol}$=0.02mol/L,
Ksp(AgCl)=c(Ag+)•c(Cl-)=1.8×10-10mol2•L-2,则c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.02}$=9×10-9mol•L-1,环境要求排放标准为c(Ag+)低于1.0×10-8mol•L-1,显然9×10-9mol•L-1<1.0×l0-8mol•L-1,
故答案为:9×10-9mol•L-1.
点评 本题考查了含硫烟气的处理及难溶物的沉淀转化,利用所学知识结合框图信息是解答本题的关键,难度中等.

| A. | c(OH-)=c(H2CO3)+c(HCO3-) | B. | 2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+(OH-) |
| A. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| B. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| C. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 | |
| D. | 聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
| A. | 20℃5 mL 0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4溶液,5mL H2O | |
| B. | 20℃5 mL 0.2mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mLH2O | |
| C. | 30℃5mL0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4 溶液,5mLH2O | |
| D. | 30℃5 mL0,2 mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mL H2O |
| A. | XY2一定是分子晶体 | B. | XY2的电子式可能是 | ||
| C. | XY2水溶液不可能呈碱性 | D. | X可能是ⅣA、ⅤA或ⅥA族元素 |
| A. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| C. | 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+═H2O+CO2↑ | |
| D. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-═AgCl↓+NO3- |