题目内容
10.用食醋、澄清石灰水等来验证牙膏中含有碳酸钙的操作及现象为其操作步骤为:将少量碳酸钙固体加入试管中,向试管中滴入少量醋酸,将生成的气体通入澄清石灰水中,看到的现象是:碳酸钙溶解且有大量气泡生成,澄清石灰水变浑浊.分析 醋酸酸性大于碳酸,所以碳酸钙和醋酸反应生成可溶性的醋酸钙,同时生成二氧化碳和水;二氧化碳能和氢氧化钙反应生成难溶性的碳酸钙,据此分析解答.
解答 解:醋酸酸性大于碳酸,所以碳酸钙和醋酸反应生成可溶性的醋酸钙,同时生成二氧化碳和水,看到的现象是:碳酸钙溶解且有大量气泡生成;二氧化碳能和氢氧化钙反应生成难溶性的碳酸钙,看到的现象是澄清石灰水变浑浊,其操作步骤为:将少量碳酸钙固体加入试管中,向试管中滴入少量醋酸,将生成的气体通入澄清石灰水中,看到的现象是:碳酸钙溶解且有大量气泡生成,澄清石灰水变浑浊,
故答案为:其操作步骤为:将少量碳酸钙固体加入试管中,向试管中滴入少量醋酸,将生成的气体通入澄清石灰水中,看到的现象是:碳酸钙溶解且有大量气泡生成,澄清石灰水变浑浊.
点评 本题考查物质检验鉴别实验方案设计,为高频考点,侧重考查学生实验操作、观察、总结归纳能力,明确物质性质是解本题关键,难点是化学用语的正确运用,题目难度不大.

练习册系列答案
相关题目
1.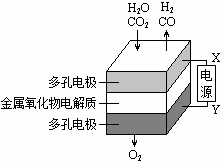 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2ˉ CO2+2eˉ=═CO+O2ˉ | |
| C. | 总反应可表示为:H2O+CO2电解_H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
18.海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-HCO3-等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
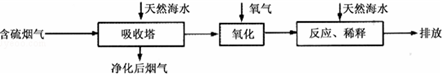
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2═2H2SO4;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为SO2+NH3•H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3.H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
Ⅱ重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(5)你认为往废水中投入B(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
( 7 )如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol/L,问该工厂处理后的废水中c(Ag+)=9×10-9 mol•L-1.(已知KSP(AgCl)=1.8×10-10)
Ⅰ火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2═2H2SO4;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为SO2+NH3•H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3.H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
Ⅱ重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶 电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
( 7 )如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol/L,问该工厂处理后的废水中c(Ag+)=9×10-9 mol•L-1.(已知KSP(AgCl)=1.8×10-10)
5.下列关于几种仪器使用的第一步的说法中,错误的是( )
| A. | 托盘天平使用前应先调“零” | |
| B. | 容量瓶使用前应先检查是否漏水 | |
| C. | 分液漏斗使用前应先检验气密性 | |
| D. | 酒精灯在使用前应先检查灯芯是否有结焦现象 |
15.勒沙特列原理是自然界一条重要的基本原理,试运用此原理分析,氯化银在下列溶液中溶解度最少的是( )
| A. | 饱和食盐水 | B. | 0.1mol•L-1的盐酸 | ||
| C. | 0.1 mol•L-1 的CaCl2 溶液 | D. | 新制的饱和氯水 |
7.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个.则这三种元素所组成的化合物的分子式不可能是( )
| A. | X2YZ4 | B. | XYZ3 | C. | X3YZ4 | D. | X4Y2Z7 |
4.下列实验不能达到目的是( )
| A. | 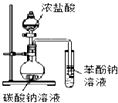 如图证明酸性:盐酸>碳酸>苯酚 | |
| B. |  如图实验室制硝基苯 | |
| C. | 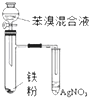 如图验证苯和液溴在催化剂作用下发生取代反应 | |
| D. | 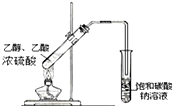 如图实验室制乙酸乙酯 |
5.下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 操 作 | 现 象 | 解释或结论 |
| A. | 过量的Fe粉中加入稀HNO3,充分反应后,滴加KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B. | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3氧化,形成致密的氧化膜 |
| C. | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| D. | 向紫色石蕊试液中通入SO2 | 溶液褪色 | SO2有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.