题目内容
12.短周期非金属元素X和Y能形成XY2型化合物,下列有关XY2的判断不正确的是( )| A. | XY2一定是分子晶体 | B. | XY2的电子式可能是 | ||
| C. | XY2水溶液不可能呈碱性 | D. | X可能是ⅣA、ⅤA或ⅥA族元素 |
分析 短周期非金属元素X和Y能形成XY2型化合物,则X可能为第ⅡA、第ⅣA族元素,Y可能为第ⅤⅡA、第ⅥA族元素,还有可能为NO2、SO2,并利用常见物质的性质来解答.
解答 解:短周期非金属元素X和Y能形成XY2型化合物,则X可能为第ⅡA、第ⅣA族元素,Y可能为第ⅤⅡA、第ⅥA族元素,还有可能为SO2,
A.如为MgCl2等化合物,在为离子化合物,故A错误;
B.如为CO2,则电子式为 ,故B正确;
,故B正确;
C.如为MgCl2等,则溶液呈中性,如为CO2、NO2、SO2,则溶液呈酸性,不可能呈碱性,故C正确;
D.由以上分析可知X可能是ⅣA、ⅤA或ⅥA族元素,故D正确.
故选A.
点评 本题考查XY2型化合物,学生熟悉常见的XY2型化合物及化合物的性质是解答本题的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-HCO3-等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
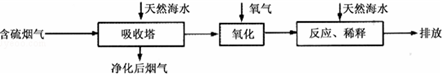
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2═2H2SO4;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为SO2+NH3•H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3.H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
Ⅱ重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(5)你认为往废水中投入B(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
( 7 )如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol/L,问该工厂处理后的废水中c(Ag+)=9×10-9 mol•L-1.(已知KSP(AgCl)=1.8×10-10)
Ⅰ火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2═2H2SO4;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为SO2+NH3•H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3.H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
Ⅱ重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶 电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
( 7 )如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol/L,问该工厂处理后的废水中c(Ag+)=9×10-9 mol•L-1.(已知KSP(AgCl)=1.8×10-10)
15.勒沙特列原理是自然界一条重要的基本原理,试运用此原理分析,氯化银在下列溶液中溶解度最少的是( )
| A. | 饱和食盐水 | B. | 0.1mol•L-1的盐酸 | ||
| C. | 0.1 mol•L-1 的CaCl2 溶液 | D. | 新制的饱和氯水 |
7.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个.则这三种元素所组成的化合物的分子式不可能是( )
| A. | X2YZ4 | B. | XYZ3 | C. | X3YZ4 | D. | X4Y2Z7 |
17.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:BBa(OH)2 CHCl DAgNO3 EAl2(SO4)3
(2)E溶液中滴加过量氨水的离子方程式Al3++3NH3•H2O?Al(OH)3↓+3NH4+;
(3)请简述A中的阳离子的检验方法及实验现象:用洁净的铂丝蘸取待测液,在酒精灯火焰上灼烧,若焰色反应显黄色,证明是钠离子
(4)在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:BBa(OH)2 CHCl DAgNO3 EAl2(SO4)3
(2)E溶液中滴加过量氨水的离子方程式Al3++3NH3•H2O?Al(OH)3↓+3NH4+;
(3)请简述A中的阳离子的检验方法及实验现象:用洁净的铂丝蘸取待测液,在酒精灯火焰上灼烧,若焰色反应显黄色,证明是钠离子
(4)在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
4.下列实验不能达到目的是( )
| A. | 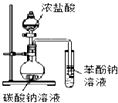 如图证明酸性:盐酸>碳酸>苯酚 | |
| B. | 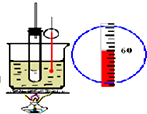 如图实验室制硝基苯 | |
| C. | 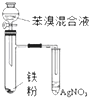 如图验证苯和液溴在催化剂作用下发生取代反应 | |
| D. | 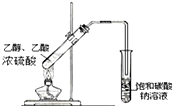 如图实验室制乙酸乙酯 |
1.下列溶液中的Cl-浓度与50mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1KCl溶液 | D. | 75 mL 1 mol•L-1 AlCl3溶液 |
2.下列溶液中,跟200mL 0.5mol/L MgCl2溶液所含的Cl-物质的量浓度相同的是( )
| A. | 100mL 0.25mol/L CaCl2溶液 | B. | 50ml 1mol/L KCl溶液 | ||
| C. | 50ml 0.5mol/L NaCl溶液 | D. | 200mL 0.25mol/L AlCl3溶液 |
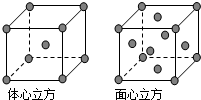 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子. ,分子中有2个σ键,2个π键.
,分子中有2个σ键,2个π键.