题目内容
3.某有机物A的蒸气对氢气的相对密度为49,取9.8g该有机物A完全燃烧后产生的气体通过浓H2SO4,浓H2SO4增重12.6g 再通过NaOH溶液,NaOH溶液增重30.8g 若此有机物A能使溴水褪色,在它的所有同分异构体中主碳链最短,试确定有机物A的分子式和结构简式.分析 根据相对密度计算出A的摩尔质量,再根据n=$\frac{m}{M}$计算出A、生成的水和二氧化碳的物质的量,从而确定有机物A中含有的C、H原子数,从而可确定其分子式;根据A的性质及限制条件形成满足条件的有机物的结构简式.
解答 解:有机物A的蒸气对氢气的相对密度为49,则A的摩尔质量为:2g/mol×49=98g/mol,
9.8g该有机物的物质的量为:$\frac{9.8g}{98g/mol}$=0.1mol,
浓H2SO4增重12.6g为水的质量,则水的物质的量为:$\frac{12.6g}{18g/mol}$=0.7mol,含有H的物质的量为1.4mol,A分子中含有H的数目为:$\frac{1.4mol}{0.1mol}$=14,
NaOH溶液增重的30.8g为二氧化碳的质量,二氧化碳的物质的量为:$\frac{30.8g}{44g/mol}$=0.7mol,A分子中含有C的数目为:$\frac{0.7mol}{0.1mol}$=7,
A分子中含有C、H的总原子量为:12×7+1×14=98,则A分子中不含O元素,其分子式为:C7H14;
若此有机物A能使溴水褪色,则A分子中含有1个碳碳双键,
分子式为C7H14的烯烃中主碳链最短的有机物的结构简式为:C(CH3)=C(CH3)-C(CH3)3,
答:有机物A的分子式为C7H14,满足条件的结构简式为C(CH3)=C(CH3)-C(CH3)3.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握质量守恒在确定有机物分子式中的应用方法,明确常见有机物结构与性质及同分异构体的书写原则.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
13.下列离子方程式正确的是( )
| A. | 实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO${\;}_{3}^{2-}$ | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2[Ag(NH3)2]++2OH- $\stackrel{水浴加热}{→}$CH3COO--+NH4++3NH3+2Ag↓+H2O |
14.为了除去酸性ZnCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,使溶液的PH值升高,过滤后再向滤液中加适量的盐酸,这种试剂是( )
| A. | KOH | B. | K2CO3 | C. | ZnSO4 | D. | Zn(OH)2 |
18.海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-HCO3-等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
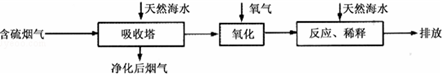
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2═2H2SO4;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为SO2+NH3•H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3.H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
Ⅱ重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(5)你认为往废水中投入B(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
( 7 )如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol/L,问该工厂处理后的废水中c(Ag+)=9×10-9 mol•L-1.(已知KSP(AgCl)=1.8×10-10)
Ⅰ火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2═2H2SO4;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为SO2+NH3•H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3.H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
Ⅱ重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶 电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
( 7 )如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol/L,问该工厂处理后的废水中c(Ag+)=9×10-9 mol•L-1.(已知KSP(AgCl)=1.8×10-10)
8.25℃时,将0.02 mol•L-1的HCOOH溶液与0.01mol•L-1的NaOH溶液等体积混合,所得溶液的pH<7.则下列关系式中不正确的是( )
| A. | c(HCOO-)>c(Na+) | B. | c(HCOOH)<c(HCOO-) | ||
| C. | c(HCOOH)+c(HCOO-)=0.02mol•L-1 | D. | 2c(H+)+c(HCOOH)=c(HCOO-)+2c(OH-) |
15.勒沙特列原理是自然界一条重要的基本原理,试运用此原理分析,氯化银在下列溶液中溶解度最少的是( )
| A. | 饱和食盐水 | B. | 0.1mol•L-1的盐酸 | ||
| C. | 0.1 mol•L-1 的CaCl2 溶液 | D. | 新制的饱和氯水 |
17.现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:BBa(OH)2 CHCl DAgNO3 EAl2(SO4)3
(2)E溶液中滴加过量氨水的离子方程式Al3++3NH3•H2O?Al(OH)3↓+3NH4+;
(3)请简述A中的阳离子的检验方法及实验现象:用洁净的铂丝蘸取待测液,在酒精灯火焰上灼烧,若焰色反应显黄色,证明是钠离子
(4)在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀.
试回答下列问题:
(1)写出化学式:BBa(OH)2 CHCl DAgNO3 EAl2(SO4)3
(2)E溶液中滴加过量氨水的离子方程式Al3++3NH3•H2O?Al(OH)3↓+3NH4+;
(3)请简述A中的阳离子的检验方法及实验现象:用洁净的铂丝蘸取待测液,在酒精灯火焰上灼烧,若焰色反应显黄色,证明是钠离子
(4)在100mL0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,最终得到沉淀物质的量为0.01 mol.
18.化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| B. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 合金材料中可能含有非金属元素 |

 ,A的二氯取代物有1种.
,A的二氯取代物有1种.