题目内容
9.在Na2CO3溶液中,下列关系正确的是( )| A. | c(OH-)=c(H2CO3)+c(HCO3-) | B. | 2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+(OH-) |
分析 Na2CO3属于强碱弱酸盐,在溶液中碳酸根离子会发生水解,Na2CO3溶液存在水解平衡CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3-+OH-,结合电荷守恒、质子守恒分析.
解答 解:A.水电离出的氢离子等于氢氧根离子,Na2CO3溶液存在水解平衡CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3-+OH-,所以c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+),故A错误;
B.碳酸钠是盐,为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,Na2CO3溶液存在水解平衡CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3-+OH-,根据钠和碳间的关系可得$\frac{1}{2}$c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),故B错误;
C.碳酸钠是盐,为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,c(Na+)>c(CO32-),Na2CO3属于强碱弱酸盐在溶液中碳酸根离子会发生水解,碳酸根离子是多元弱酸阴离子分步水解,水解的离子方程式为:CO32-+H2O?OH-+HCO3-,HCO3-+H2O?H2CO3-+OH-,所以c(CO32-)>c(OH-)>c(HCO3-),故C正确;
D.根据电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+(OH-),故D错误;
故选C.
点评 本题考查了盐的水解原理,注意把握盐的水解对盐电离出来的离子浓度的影响,题目难度中等.

练习册系列答案
相关题目
19.两种气态烃的混合物共0.1mol,完全燃烧后得3.36L(标准状况)CO2和3.6克水,下列说法正确的是( )
| A. | 一定有乙烯 | B. | 一定有甲烷 | ||
| C. | 可能有乙烷 | D. | 一定是甲烷和乙烯的混合物 |
14.为了除去酸性ZnCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,使溶液的PH值升高,过滤后再向滤液中加适量的盐酸,这种试剂是( )
| A. | KOH | B. | K2CO3 | C. | ZnSO4 | D. | Zn(OH)2 |
1.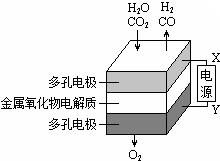 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2ˉ CO2+2eˉ=═CO+O2ˉ | |
| C. | 总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
18.海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO42-、Br-、CO32-HCO3-等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
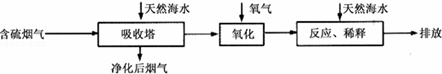
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2═2H2SO4;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为SO2+NH3•H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3.H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
Ⅱ重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(5)你认为往废水中投入B(填字母序号),沉淀效果最好.
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
( 7 )如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol/L,问该工厂处理后的废水中c(Ag+)=9×10-9 mol•L-1.(已知KSP(AgCl)=1.8×10-10)
Ⅰ火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释主要原因CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2═2H2SO4;氧化后的“海水”需要用大量的天然海水与之混后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=2c(SO32-)+c(HSO3-)(用含硫微粒浓度的代数式表示).
(4)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为SO2+NH3•H2O=NH4++HSO3-,所得溶液中c(H+)-c(OH-)=BD (填字母编号).
A.c(SO32-)-c(H2SO3) B.c(SO32-)+c(NH3.H2O)-c(H2SO3)
C.c(HSO3-)+c(SO32-)-c(NH4+) D.c(HSO3-)+2c(SO32-)-c(NH4+)
Ⅱ重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g/mL)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶 电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(6)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
( 7 )如果用食盐处理只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1).若环境要求排放标准为c(Ag+)低于1.0×10-8mol/L,问该工厂处理后的废水中c(Ag+)=9×10-9 mol•L-1.(已知KSP(AgCl)=1.8×10-10)
4.下列实验不能达到目的是( )
| A. | 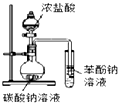 如图证明酸性:盐酸>碳酸>苯酚 | |
| B. |  如图实验室制硝基苯 | |
| C. | 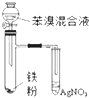 如图验证苯和液溴在催化剂作用下发生取代反应 | |
| D. | 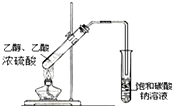 如图实验室制乙酸乙酯 |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题. A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.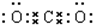 ,分子中有2个σ键,2个π键.
,分子中有2个σ键,2个π键.