题目内容
3.下列说法正确的是(其中NA表示阿伏伽德罗常数)( )| A. | 常温常压下,0.1mol D216O中含中子数、质子数、电子数均为NA | |
| B. | 比黄金还贵的18O2和普通的16O2是两种不同的核素 | |
| C. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | 1L2mol•L-1的Al(NO3)3溶液中含Al3+个数为2NA |
分析 A.依据n=mMmM计算物质的量,再计算微粒数;
B.18O2和普通的16O2是单质;
C.氯气溶于水部分与水反应;
D.硝酸铝溶液中铝离子发生了水解,物质的量减少.
解答 解:A.依据2gD216O的物质的量=2g20g/mol2g20g/mol=0.1mol,故所含有的质子数为0.1mol×10=1mol,即NA个、含有的中子数为0.1mol×10=1mol,即NA个、含有的电子数为0.1mol×10=1mol,即NA个,故A正确;
B.18O2和普通的16O2是单质,不是核素,故B错误;
C.标准状况下,2.24L Cl2物质的量为0.1mol,溶于水部分和水反应,转移的电子数目小于0.1NA,故C错误;
D.硝酸铝溶液中,铝离子能够水解,物质的量变小,故Al3+个数小于2NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的应用,主要考查溶液离子物质的量计算,质量换算物质的量计算微粒数,气体摩尔体积的条件应用,注意盐类的水解规律,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13. 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )| A. | W的氢化物沸点高于水的沸点 | |
| B. | Q与氢形成的化合物一定含极性键,可能含有非极性键 | |
| C. | R的最高正价氧化物的水化物是弱电解质 | |
| D. | T与W的化合物可通过T、W的简单离子的水溶液混合制取 |
11.电解是工业生产的常用方法.某研究性小组进行以下相关探究:
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
化学小组分析提出:①白色物质为CuCl.
②红色物质可能有Cu;或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2△_△––––––2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是W1−W235.5W1−W235.5mol.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为20m−nV4020m−nV40mol•L-1.
实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.
查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
②红色物质可能有Cu;或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2△_△––––––2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是W1−W235.5W1−W235.5mol.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为20m−nV4020m−nV40mol•L-1.
8.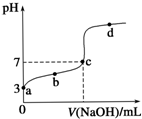 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3 mol•L-1 | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点表示的溶液中c(CH3COO−)•c(H+)c(CH3COOH)c(CH3COO−)∙c(H+)c(CH3COOH) 均等于K |
13.短周期元素X,Y,Z在元素周期表中的位置如图所示,其中Y元素原子的最外层电子数是电子层数的两倍.回答下列问题:
(1)Y元素在元素周期表中的位置是第三周期第VIA族.
(2)下列能证明Y元素与Z元素的得电子能力强弱的是:BC(填序号).
A.氢化物水溶液的酸性
B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性
D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示):S2->Cl-.
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种气体,该气体与空气中的一种气体成分相同.该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.若反应中3.01×1022个电子发生转移,则有4g的CuO参加反应.
| X | ||
| Y | Z |
(2)下列能证明Y元素与Z元素的得电子能力强弱的是:BC(填序号).
A.氢化物水溶液的酸性
B.最高价氧化物对应的水化物的酸性
C.气态氢化物的稳定性
D.与金属化合时每个原子得电子的多少
(3)比较Y和Z简单离子半径大小(用离子符号表示):S2->Cl-.
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种气体,该气体与空气中的一种气体成分相同.该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.若反应中3.01×1022个电子发生转移,则有4g的CuO参加反应.




