题目内容
15.(1)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD(填序号)A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)23℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中离子浓度大小关系是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18. (已知醋酸的电离平衡常数Ka=1.8×10-5)
分析 (1)CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,c(OH-)增大,Kw不变;
(2)①根据溶液中的电荷守恒和物料守恒来计算;
②25℃时,混合液pH=6,溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度,据此判断离子浓度大小顺序;25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-),根据缓冲溶液中的缓冲公式来计算c(CH3COO-)/c(CH3COOH).
解答 解:(1)A.CH3COOH溶液加水稀释过程,虽促进电离,但c(H+)减小,故A不选;
B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,CH3COOH溶液加水稀释过程,促进电离,氢离子物质的量增大,醋酸物质的量减小,则稀释过程中比值变大,故B选;
C.稀释过程,c(H+)减小,c(OH-)增大,c(H+)•c(OH-)=Kw,Kw只受温度影响所以不变,故C不选;
D.稀释过程,c(H+)减小,c(OH-)增大,则$\frac{c(O{H}^{-})}{c({H}^{+})}$变大,故D选;
故答案为:BD;
(2)25℃时,混合液pH=6,溶液呈酸性,c(H+)>c(OH-),说明醋酸的电离程度大于醋酸根的水解程度,故c(CH3COO-)>c(Na+),醋酸的电离程度不大,故离子浓度大小顺序c(CH3COO-)>c(Na+)>c(H+)>c(OH-),①CH3COOH与CH3COONa的混合溶液中,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,故答案为:9.9×10-7;
②根据缓冲公式pH=pKa-lg($\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$),25℃时CH3COOH的 Ka=1.8×10-5,pKa(CH3COOH)=4.76,所以lg($\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$)=-1.24,即$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18,
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);18.
点评 本题考查pH与酸的稀释等,注意水解规律中越弱越水解和稀释中强的变化大来分析解答,综合性较大,题目难度中等.

(1)选取必要的实验装置,正确的连接顺序为CAB(填序号).
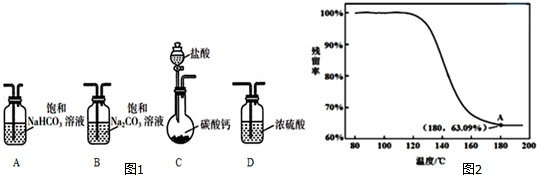
(2)为确定制得的固体样品是纯净的NaHCO3,小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案不可行(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
[己知:0.l mol•L-1 NaHCO3溶液电离出的c(CO32-)为0.001l mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(ii)产生浑浊(伴有气体产生)的离子方程式Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}$×100%)
| A. | 常温常压下,0.1mol D216O中含中子数、质子数、电子数均为NA | |
| B. | 比黄金还贵的18O2和普通的16O2是两种不同的核素 | |
| C. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | 1L2mol•L-1的Al(NO3)3溶液中含Al3+个数为2NA |
| A. | 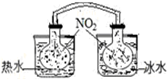 依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 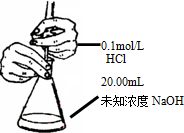 测定锥形瓶内的NaOH的浓度 | |
| C. | 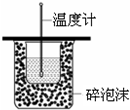 测定中和热 | |
| D. | 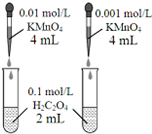 依据褪色快慢比较浓度对反应速率的影响 |
| A. | Na、Al、Fe、Cu在空气中都易生锈是因为都生成了对应的氧化物 | |
| B. | 在高温下用氢气还原MgCl2可制取金属镁 | |
| C. | 实验测得NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性CH3COOH>H2CO3 | |
| D. | 高温时,CuO比Cu2O稳定,Na2O2比Na2O稳定 |
| A. | C1>C2 | B. | C1=C2 | C. | C1<C2 | D. | 无法确定 |
| A. | 2种 | B. | 4种 | C. | 3种 | D. | 6种 |