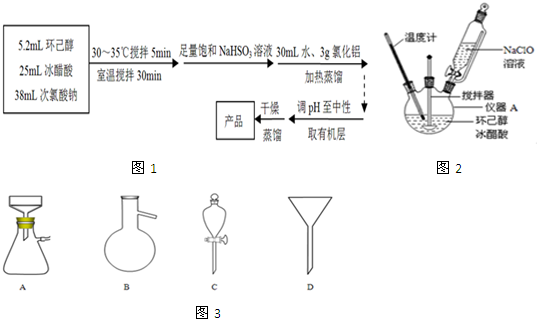
题目内容
18.化学与生产、生活、社会密切相关,下列说法错误的是( )| A. | 葡萄糖、麦芽糖均能与银氨溶液反应 | |
| B. | 甘氨酸和丙氨酸缩合最多可以形成四种二肽 | |
| C. | 富含蛋白质的豆浆煮沸后即可得人体所需的氨基酸 | |
| D. | 油酯在氢氧化钾溶液中水解可制得汽车洗涤用的液体肥皂 |
分析 A.葡萄糖和麦芽糖均为还原性糖,均能与银氨溶液反应;
B.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,两个氨基酸分子脱去一个水分子脱水结合形成二肽,既要考虑不同氨基酸分子间生成二肽,又要考虑同种氨基酸分子间形成二肽;
C.蛋白质在加热条件下发生变性,而不是发生水解反应生成氨基酸;
D.油脂是高级脂肪酸甘油酯,油脂在碱性条件下发生皂化反应.
解答 解:A.葡萄糖和麦芽糖均为还原性糖,均能与银氨溶液反应,故A正确;
B.氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子.当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,所以共有4种,故B正确;
C.蛋白质在加热条件下发生变性,需要在催化剂的作用下,蛋白质才会发生水解反应生成氨基酸,故C错误;
D.油脂是高级脂肪酸甘油酯,油脂在碱性条件下发生皂化反应,故D正确;
故选C.
点评 本题考查了糖类、油脂和蛋白质的结构、性质和用途,难度不大,B选项关键在于形成肽键既要考虑不同氨基酸分子间形成肽键,又要考虑同种氨基酸分子间形成肽键.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
8. 利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.
利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.
【查阅资料】硫酸铵化肥品质的束腰指标如表:
【观察外观】该硫酸铵化肥无可见机械杂质.
实验一:气体法测定含氮量.(实验装置如图1所示)
(1)烧瓶内发生反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;烧杯中盛放的试剂最好是稀硫酸(填“浓硫酸”、“稀硫酸”或“水”)
(2)甲同认为根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:A、B装置间缺一个干燥装置.针对甲同学指出的缺陷,他们改进了实验装置,重新进行实验,准确测得氢气的质量.
实验二:甲醛法测定含氮量.
已知:①甲醛结构简式为HCHO,在空气中易被氧化成甲酸,甲酸酸性比乙醛强.
②甲醛法的反应原理为:4NH4++6HCHO→4H++6H2O+(CH2)6N4生成的酸再用NaOH标准溶液滴定,从而测定氮的含量.
(1)实验步骤:称取固体(NH4)2SO4样品0.600g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液,用②(填图2中仪器编号)滴定管准确取出20.00mL的溶液与锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴指示剂(已知滴定终点的pH约为8.8),用浓度为0.1000mol•L-1 NaOH标准溶液滴定,读数如表:
(2)探究结论,该化肥是(填“是”或“不是”)一等品.
(3)若滴定前待测也加甲醛后露置空气时间过长,则所测定的含氮量比实际值偏大(填“偏大”“偏小”或“无影响”).
实验三:测定碳酸氢铵中的含氮量
碳酸氢铵也是常用的氮肥,如果测定其含氮量,应选择的方法是气体法(填“气体法”或“甲醛法”),不选择另一种方法的理由是甲醛法用氢氧化钠标准溶液滴定时,溶液中HCO3-中的H+也会和氢氧化钠中和.
 利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.
利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.【查阅资料】硫酸铵化肥品质的束腰指标如表:
| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
实验一:气体法测定含氮量.(实验装置如图1所示)
(1)烧瓶内发生反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;烧杯中盛放的试剂最好是稀硫酸(填“浓硫酸”、“稀硫酸”或“水”)
(2)甲同认为根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:A、B装置间缺一个干燥装置.针对甲同学指出的缺陷,他们改进了实验装置,重新进行实验,准确测得氢气的质量.
实验二:甲醛法测定含氮量.
已知:①甲醛结构简式为HCHO,在空气中易被氧化成甲酸,甲酸酸性比乙醛强.
②甲醛法的反应原理为:4NH4++6HCHO→4H++6H2O+(CH2)6N4生成的酸再用NaOH标准溶液滴定,从而测定氮的含量.
(1)实验步骤:称取固体(NH4)2SO4样品0.600g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液,用②(填图2中仪器编号)滴定管准确取出20.00mL的溶液与锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴指示剂(已知滴定终点的pH约为8.8),用浓度为0.1000mol•L-1 NaOH标准溶液滴定,读数如表:
| 滴定次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 1.20 | 18.91 |
| 2 | 0.00 | 18.60 |
| 3 | 1.10 | 18.79 |
(3)若滴定前待测也加甲醛后露置空气时间过长,则所测定的含氮量比实际值偏大(填“偏大”“偏小”或“无影响”).
实验三:测定碳酸氢铵中的含氮量
碳酸氢铵也是常用的氮肥,如果测定其含氮量,应选择的方法是气体法(填“气体法”或“甲醛法”),不选择另一种方法的理由是甲醛法用氢氧化钠标准溶液滴定时,溶液中HCO3-中的H+也会和氢氧化钠中和.
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12L1H2和0.2g 2H2均含有0.1NA个质子 | |
| B. | 在同压不同温的情况下,质量相同的氧气和臭氧所含氧原子数不相同 | |
| C. | 标准状况下,11.2L庚烷完全燃烧后生成的CO2分子数为3.5NA | |
| D. | 常温下,将5.6 g 铁投入足量的浓硫酸中转移电子数为0.3 NA |
6.化学与生活密切相关,下列说法不正确的是( )
| A. | Fe2O3常用作红色油漆和涂料 | B. | 氟氯烃是安全、环保的制冷剂 | ||
| C. | 聚丙烯酸钠可做“尿不湿”原料 | D. | 硅胶可用作瓶装药品干燥剂 |
13.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 12.4 g白磷中含有共价键数为0.4 NA | |
| B. | 3Fe+4H2O(g)=Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移 | |
| C. | 在1 L 0.1 mol/L碳酸钠溶液中阴离子总数等于0.1 NA | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
3.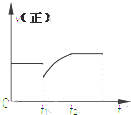 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )| A. | 增大NH3浓度的同时减小N2浓度 | B. | 增大N2和H2的浓度 | ||
| C. | 扩大容器的体积 | D. | 降低反应温度 |
10.硫及其化合物有广泛应用.
(1)硫元素在周期表中的位置是第三周期ⅥA族.
(2)硒(34Se)与硫在元素周期表中位于同一主族.下列说法正确的是cd.
a.沸点:H2Se>H2S>H2O
b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大
d.SeO2和SO2含有的化学键类型相同
(3)SO2可用于制H2SO4.已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
H2O(g)=H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.
(4)为研究H2SO4生产中SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO2 7%、O2 11%、N2 82%)使之发生反应,在101kPa下达到平衡,得到如下数据:
根据上述数据,达平衡态时N2的体积分数随着温度升高而减小(填“增大”、“减小”或“不变”);575℃达平衡时,SO3的体积分数为5.8%(保留一位小数).
(5)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性.
①吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-.
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色.
(1)硫元素在周期表中的位置是第三周期ⅥA族.
(2)硒(34Se)与硫在元素周期表中位于同一主族.下列说法正确的是cd.
a.沸点:H2Se>H2S>H2O
b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大
d.SeO2和SO2含有的化学键类型相同
(3)SO2可用于制H2SO4.已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
H2O(g)=H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.
(4)为研究H2SO4生产中SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO2 7%、O2 11%、N2 82%)使之发生反应,在101kPa下达到平衡,得到如下数据:
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
(5)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性.
①吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-.
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色.
7.下列化学用语正确的是( )
| A. | 甲基的电子式是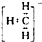 | B. | 硫的原子结构示意图是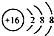 | ||
| C. | ${\;}_{8}^{18}$O表示中子数是18的氧原子 | D. | 过氧化氢的结构式是H-O-O-H |