题目内容
1.分析下列各项结构的规律,按此规律排布第10项的分子式应为( )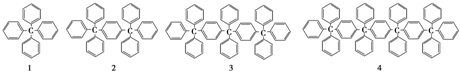
| A. | C198H146 | B. | C196H155 | C. | C196H146 | D. | C198H155 |
分析 1分子式为:C25H20,2分子式为:C44H34,3分子式为:C63H48,由此规律得到,C的个数为25+(n-1)×19,H的个数为:20+(n-1)×15-(n-1),据此第10个分子式可求.
解答 解:1分子式为:C25H20,2分子式为:C44H34,3分子式为:C63H48,由此规律得到,C的个数为25+(n-1)×19,H的个数为:20+(n-1)×15-(n-1),据此第10个分子式中C的个数为:25+(10-1)×19=196,H的个数为:20+(10-1)×15-(10-1)=146,故分子式为:C196H146,故选C.
点评 本题考查了有机物结构的变化规律,中等难度,找出相邻烃的变化特点是解题关键.

练习册系列答案
相关题目
11.化学与科学、社会、技术和环境密切相关.下列有关说法中错误的是( )
| A. | 目前科学家已制得单原子层锗,其电子迁移率是硅的10倍,有望用于制造高能计算机芯片 | |
| B. | 2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代,利用此类光显微镜可以观察活细胞内蛋白质等大分子 | |
| D. | 绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
12.锂离子电池种类很多,其中有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中而形成的,电池总反应方程式为8Li+3SOCl2=6LiCl+Li2SO3+2S,则下列叙述中错误的是( )
| A. | 电解质溶液中混入水,会影响电池反应 | |
| B. | 反应中,SOCl2既是溶剂,又是氧化剂 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2) 被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出硫物质的量之比为4:1 |
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12L1H2和0.2g 2H2均含有0.1NA个质子 | |
| B. | 在同压不同温的情况下,质量相同的氧气和臭氧所含氧原子数不相同 | |
| C. | 标准状况下,11.2L庚烷完全燃烧后生成的CO2分子数为3.5NA | |
| D. | 常温下,将5.6 g 铁投入足量的浓硫酸中转移电子数为0.3 NA |
6.化学与生活密切相关,下列说法不正确的是( )
| A. | Fe2O3常用作红色油漆和涂料 | B. | 氟氯烃是安全、环保的制冷剂 | ||
| C. | 聚丙烯酸钠可做“尿不湿”原料 | D. | 硅胶可用作瓶装药品干燥剂 |
13.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 12.4 g白磷中含有共价键数为0.4 NA | |
| B. | 3Fe+4H2O(g)=Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移 | |
| C. | 在1 L 0.1 mol/L碳酸钠溶液中阴离子总数等于0.1 NA | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
10.硫及其化合物有广泛应用.
(1)硫元素在周期表中的位置是第三周期ⅥA族.
(2)硒(34Se)与硫在元素周期表中位于同一主族.下列说法正确的是cd.
a.沸点:H2Se>H2S>H2O
b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大
d.SeO2和SO2含有的化学键类型相同
(3)SO2可用于制H2SO4.已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
H2O(g)=H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.
(4)为研究H2SO4生产中SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO2 7%、O2 11%、N2 82%)使之发生反应,在101kPa下达到平衡,得到如下数据:
根据上述数据,达平衡态时N2的体积分数随着温度升高而减小(填“增大”、“减小”或“不变”);575℃达平衡时,SO3的体积分数为5.8%(保留一位小数).
(5)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性.
①吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-.
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色.
(1)硫元素在周期表中的位置是第三周期ⅥA族.
(2)硒(34Se)与硫在元素周期表中位于同一主族.下列说法正确的是cd.
a.沸点:H2Se>H2S>H2O
b.H2Se比H2S稳定性强
c.Se的原子半径比S原子大
d.SeO2和SO2含有的化学键类型相同
(3)SO2可用于制H2SO4.已知25℃、101kPa时:
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H1=-545kJ/mol
H2O(g)=H2O(l)△H2=-44kJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H3=-130kJ/mol
则2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.
(4)为研究H2SO4生产中SO2催化氧化时温度对SO2平衡转化率的影响,进行如下试验.取100L原料气(体积分数为SO2 7%、O2 11%、N2 82%)使之发生反应,在101kPa下达到平衡,得到如下数据:
| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
(5)废气中的SO2可用NaOH溶液吸收,吸收SO2后的碱性溶液还可用于Cl2的尾气处理,吸收Cl2后的溶液仍呈强碱性.
①吸收Cl2后的溶液中一定存在的阴离子有OH-、SO42-、Cl-.
②吸收Cl2后的溶液中可能存在SO32-,取该溶液于试管中,滴加黄色的溴水,得到无色溶液.此实验不能证明溶液中含有SO32-,理由是NaOH溶液能跟溴单质反应,使溶液呈无色.
11.常温下,下列溶液的离子浓度关系正确的是( )
| A. | pH=4的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-4mol/L | |
| B. | pH=x的CH3COOH溶液100mL,稀释10倍后pH=y,x-y>1 | |
| C. | pH=2的NaHC2O4溶液与pH=12的NaOH溶液以任意比混合,混合液中:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | pH相同的①CH3COONa、②Na2CO3 、③NaClO三种溶液中c(Na+):①>②>③ |
 ;
;