题目内容
13.下列有关叙述不正确的是( )| 选项 | 已知 | 解释与结论 |
| A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
| B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
| C | 常温下,Ksp(AgCl)=1.8×10-10、 Ksp(AgBr)=5.4×10-13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=3×10-3 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A、Al在浓硝酸中钝化,Cu能够与浓硝酸反应;
B、△H-T△S<0的反应能够自发进行;
C、当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$,依此计算;
D、硝酸也能将亚铁离子氧化生成铁离子.
解答 解:A、在浓硝酸、Al、Cu原电池中,Cu作负极,发生氧化反应,Al钝化作正极,故A正确;
B、该反应的△S<0,常温下能自发进行,必须△H<0,故B正确;
C、当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=$\frac{Ksp(AgBr)}{c(A{g}^{+})}$,c(Cl-)=$\frac{Ksp(AgCl)}{c(A{g}^{+})}$,
则$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$=$\frac{5.4×1{0}^{-13}}{1.8×1{0}^{-10}}$=3×10-3,故C正确;
D、硝酸能将亚铁离子氧化为铁离子,所以不能判断氧化性:H2O2>Fe3+,故D错误;
故选D.
点评 本题考查了原电池原理、反应自发进行的条件、溶液中离子浓度的计算、氧化还原反应,为常见题型,题目难度不大.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
7.下列装置所示的实验不能达到目的是( )
| A. | 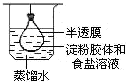 净化精制淀粉胶体 | B. |  测定化学反应速率 | ||
| C. | 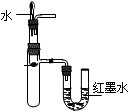 验证Na与水反应是否放热 | D. | 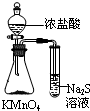 比较KMnO4、Cl2、S的氧化剂 |
1.化学与人们的日常生活密切相关,下列叙述正确的是( )
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
8.下列关于有机化合物1和2的说法中,正确的是( )
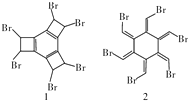

| A. | 有机物1和2互为同分异构体,分子式为C12H6Br6 | |
| B. | 有机物1和2在氢氧化钠的乙醇溶液中均可发生消去反应 | |
| C. | 有机物1和2中所有原子均共平面 | |
| D. | 有机物2能使酸性高锰酸钾溶液褪色,而有机物1不能使酸性高锰酸钾溶液褪色 |
2.下列反应中属于吸热反应的是( )
| A. | 钠跟水反应 | |
| B. | Ba(OH)2•8H20晶体与NH4Cl晶体的反应 | |
| C. | 硫酸与氢氧化钡溶液反应 | |
| D. | 煤的燃烧 |
3.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| B. | 10 mL 0.1 mol•L-1CH3COONa溶液与6 mL 0.2 mol•L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1NH4HSO4溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 HCN溶液和0.05 mol•L-1 NaOH溶液等体积混合(pH>7):c(HCN)+c(H+)>c(OH-)+c(CN-) |

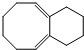 )与乙烯通过烯烃复分解进行如图所示的一系列反应:
)与乙烯通过烯烃复分解进行如图所示的一系列反应: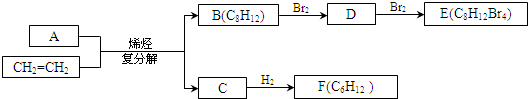
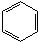 $\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式
$\stackrel{Ⅰ}{→}$ X $\stackrel{Ⅱ}{→}$ Y $\stackrel{Ⅲ}{→}$ C,步骤Ⅰ所用的试剂和条件是液溴、溴化铁催化,步骤Ⅱ的反应类型为加成,写出步骤Ⅲ的化学反应方程式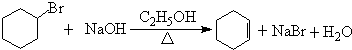

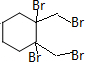 +4KOH
+4KOH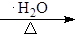
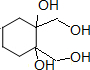 +4KBr.
+4KBr.