题目内容
3.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| B. | 10 mL 0.1 mol•L-1CH3COONa溶液与6 mL 0.2 mol•L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1NH4HSO4溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 HCN溶液和0.05 mol•L-1 NaOH溶液等体积混合(pH>7):c(HCN)+c(H+)>c(OH-)+c(CN-) |
分析 A.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
B.n(CH3COONa)=0.1mol/L×0.01L=0.001mol、n(HCl)=0.2mol/L×0.006L=0.0012mol,二者混合后,醋酸钠完全反应、盐酸有剩余,溶液呈酸性;
C.0.1 mol•L-1NH4HSO4溶液与0.1 mol•L-1NaOH溶液等体积混合,二者恰好反应生成硫酸铵和硫酸钠,铵根离子水解导致溶液呈酸性;
D.0.1 mol•L-1 HCN溶液和0.05 mol•L-1 NaOH溶液等体积混合,溶液中的溶质为等物质的量浓度的NaCN和HCN,溶液呈碱性,说明CN-的水解程度大于HCN电离程度.
解答 解:A.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(NH4+)+c(H+),根据物料守恒得c(Cl-)=c(NH3•H2O)+c(NH4+),所以得c(H+)=c(NH3•H2O)+c(OH-),故A正确;
B.n(CH3COONa)=0.1mol/L×0.01L=0.001mol、n(HCl)=0.2mol/L×0.006L=0.0012mol,二者混合后,醋酸钠完全反应、盐酸有剩余,溶液呈酸性,则c(H+)>c(OH-),故B错误;
C.0.1 mol•L-1NH4HSO4溶液与0.1 mol•L-1NaOH溶液等体积混合,二者恰好反应生成硫酸铵和硫酸钠,铵根离子水解导致溶液呈酸性,但铵根离子水解程度较小,所以离子浓度大小顺序是c(Na+)>c(NH4+)>c(H+)>c(OH-),故C错误;
D.0.1 mol•L-1 HCN溶液和0.05 mol•L-1 NaOH溶液等体积混合,溶液中的溶质为等物质的量浓度的NaCN和HCN,溶液呈碱性,说明CN-的水解程度大于HCN电离程度,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CN-),根据物料守恒得c(Na+)<c(HCN),所以c(HCN)+c(H+)>c(OH-)+c(CN-),故D正确;
故选AD.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,注意守恒规律的灵活运用,易错选项是D,采用代换法分析,题目难度中等.

| 选项 | 已知 | 解释与结论 |
| A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
| B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
| C | 常温下,Ksp(AgCl)=1.8×10-10、 Ksp(AgBr)=5.4×10-13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=3×10-3 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
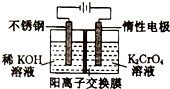 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )| A. | 在阳极室,通电后溶液逐渐由橙色变为黄色 | |
| B. | 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g | |
| C. | 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d |
| A. | HClO的结构式:H-Cl-O | |
| B. | NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | 羟基的电子式: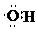 | |
| D. | 异丙醇的结构简式:CH3CH2CH2OH |
| A. | 等物质的量的OH-与羟基(-OH)所含电子数相等 | |
| B. | 常温常压下,44 g CO2气体含有氧原子的个数为2 NA | |
| C. | 1 L 0.5 mol•L-1NaHCO3溶液中含有HCO3-的个数为0.5 NA | |
| D. | 11.2 g铁粉与稀硝酸反应转移电子数一定为0.6 NA |
| A. | 电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移 | |
| B. | 含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 | |
| C. | 28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
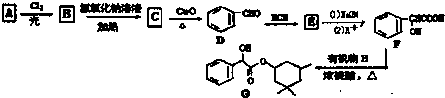
 ,D→E的反应类型为加成反应
,D→E的反应类型为加成反应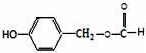
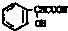 在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式
在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式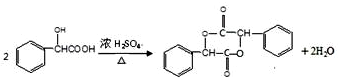
 海洋是巨大的资源宝库,具有美好的前景.
海洋是巨大的资源宝库,具有美好的前景.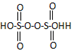 所示.
所示.