题目内容
18.第四周期元素的单质及化合物在工农业生产中应用广泛.回答以下问题:(1)铁合金中常含有碳、铁、碳材料在日常生活、工业生产和科学研究中具有极其重要的用途.
①铁元素基态原子核外未成对电子数有4.
②足球烯(C60)熔沸点较低,硬度较小,易溶于苯、酒精等有机溶剂,不导电.C60的晶体类型是分子晶体.
③低温条件下合成金刚石的反应如下:4Na+3CO2$\frac{\underline{\;400℃,800atm\;}}{\;}$C+2Na2CO3
上述反应中四种物质按照熔点由高到低的顺序是C>Na2CO3>Na>CO2.
该反应中涉及的元素按电负性从大到小的顺序是O>C>Na.
④以丙烯腈为原料可制得质轻、有很高的抗拉强度和弹性的聚丙烯腈碳纤维,该纤维广泛应用于制造高级文体用品.丙烯腈(CH2=CH-C≡N)分子中,σ键和π键的个数比为2:1;该分子中碳原子的轨道杂化类型有sp2杂化、sp杂化.
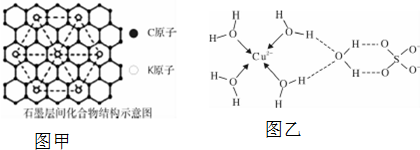
⑤石墨层间化合物在电池材料、储氢材料等方面具有广阔应用前景.某种石墨层间化合物是在石墨层间插入钾,其结构如图甲所示.该化合物化学式为KC8.
(2)第四周期元素中,基态原子的最外层只有1个电子的元素共有3种.
(3)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是C(填序号).
A.氯化钙受热挥发 B.氯化钙受热分解 C.钙离子中电子跃迁 D.氯离子中电子跃迁
(4)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色.科学家通过X射线测定出胆矾的结构,其结构可用图乙表示.
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力氢键和离子键.
②铜离子形成胆矾中配位离子的离子方程式为Cu2++4H2O=[Cu(H2O)4]2+.
(5)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如下表.据表判断Mn 2+、Fe 2+再失去一个电子的难易,并从原子结构的角度简述其原因Mn2+再失去电子比Fe2+更难,原因是Mn2+(3d5)属于较稳定的半充满结构,而Fe2+的电子排布为[Ar]3d6,易失去1个电子形成较稳定的半充满结构.
| 元素 | Mn | Fe | |
| 电离能 KJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
分析 (1)①铁是26号元素,电子排布式为1s22s22p63s23p663d6 4s2,d能级上有未成对电子;
②分子晶体熔沸点较低;
③物质熔点可根据晶体类型判断,原子晶体的>离子晶体>金属晶体>分子晶体;
同一周期元素电负性从左到右渐增,同一主族元素电负性从上到下逐渐减小;
④根据杂化轨道数=σ键数目+孤对电子对数,确定杂化轨道;根据1个单键是1个σ键,一个双键含有1个σ键和1个π键,一个三键含有1个σ键和2个π键;
⑤利用均摊法计算碳原子和钾原子个数之比,注意每个钾原子被六个三角形共用很关键;
(2)第四周期元素中,基态原子的最外层只有1个电子的元素K、Cr、Cu;
(3)钙元素的焰色反应为砖红色,进行焰色反应时,吸收能量,钙离子电子发生跃迁;
(4)①由图可知H与O之间存在氢键,铜离子与硫酸根之间存在离子键;
②铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)4]2+;
(5)电离能越大,越不容易失去电子,根据第三电离能可知Mn2+再失去电子比Fe2+更难,电子处于半满、全满、全空是更稳定.
解答 解:(1)①铁是26号元素,电子排布式为1s22s22p63s23p663d6 4s2,根据泡利原理和洪特规则知d能级上有未成对电子,由于d能级有5个轨道,d能级有4个未成对电子,故答案为:4;
②足球烯(C60)熔沸点较低,硬度较小,易溶于苯、酒精等有机溶剂,属于分子晶体,故答案为:分子晶体;
③金刚石为原子晶体,碳酸钠为离子晶体,金属钠为金属晶体,二氧化碳为分子晶体,故其熔点大小顺序为C>Na2CO3>Na>CO2;
同一周期元素电负性从左到右渐增,同一主族元素电负性从上到下逐渐减小,电负性从大到小的顺序是O>C>Na;
故答案为:C>Na2CO3>Na>CO2;O>C>Na;
④丙烯腈(CH2=CH-C≡N)分子中含有6个σ键和3个π键,数目之比为 2:1;
丙烯腈分子CH2=CH-CN中双键上的碳原子形成3个σ键,无孤电子对,sp2杂化,与氮相连的碳原子形成2个σ键,无孤电子对,sp杂化;
故答案为:2:1;sp2杂化、sp杂化;
⑤可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,占有的钾原子数为$\frac{1}{6}$×3=$\frac{1}{2}$,碳原子数和钾原子数之比是4:$\frac{1}{2}$=8:1,该化合物化学式为KC8,故答案为:KC8;
2)第四周期元素中,基态原子的最外层只有1个电子的元素K、Cr、Cu,有3种,故答案为:3;
(3)钙元素进行焰色反应时,吸收能量,钙离子电子发生跃迁,产生发射光谱为砖红色;
故答案为:C;
(4)①由图可知H与O之间存在氢键,铜离子与硫酸根之间存在离子键;
故答案为:氢键;离子键;
②铜离子与水分子通过配位键形成水合铜离子[Cu(H2O)4]2+,离子方程式为Cu2++4H2O=[Cu(H2O)4]2+,故答案为:Cu2++4H2O=[Cu(H2O)4]2+;
(5)Mn的I3=3248 kJ•mo1-1大于Fe的I3=2957 kJ•mo1-1,所以Mn2+再失去电子比Fe2+更难,原因是Mn2+(3d5)属于较稳定的半充满结构,而Fe2+的电子排布为[Ar]3d6,易失去1个电子形成较稳定的半充满结构.
故答案为:Mn2+再失去电子比Fe2+更难,原因是Mn2+(3d5)属于较稳定的半充满结构,而Fe2+的电子排布为[Ar]3d6,易失去1个电子形成较稳定的半充满结构.
点评 本题考查物质结构和性质,综合性较强,涉及晶胞计算、原子杂化、配合物、原子核外电子排布等知识点,难点是晶胞计算,侧重考查学生空间选项能力及计算能力,题目难度中等.

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案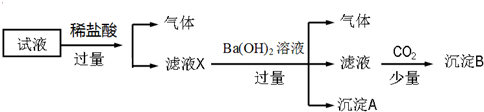
下列说法正确的是( )
| A. | 无法确定原试液中是否含有Fe3+、K+ | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ | |
| C. | 无法确定沉淀B的成分 | |
| D. | 原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42- |
 下列说法正确的是( )
下列说法正确的是( )①实验室能用酒精灯加热的有蒸发皿、圆底烧瓶、烧杯
②若蒸馏100ml石油可将其置于250ml蒸馏烧瓶中
③新制的氯水保存在棕色广口瓶中,并放在阴凉处
④波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中
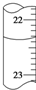
⑤若滴定管中的液面如图所示,则其读数应为23.65mL.
| A. | ①② | B. | ①③④ | C. | ③④⑤ | D. | ②③⑤ |
| 选项 | 已知 | 解释与结论 |
| A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
| B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
| C | 常温下,Ksp(AgCl)=1.8×10-10、 Ksp(AgBr)=5.4×10-13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=3×10-3 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | pH=2的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 | |
| B. | 向NaHC03溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO-)增 大 | |
| C. | Na2C03溶液中:即c(Na+)>C(CO32-)>C(OH-)=C(HCO3-)>C(H+) | |
| D. | 将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:C(Na+)+c(H+)=C(CH3COO-)+C(OH-) |
| A. | 1molCO2通入750mL 2mol/LKOH溶液中:(K+)=2 c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 加入铝粉有气泡产生的溶液中存在离子:Na+、NH4+、Fe2+、NO3- | |
| C. | 等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应的离子方程式:CO32-+Ca2++H++OH-=CaCO3↓+H2O | |
| D. | Ca与O元素形成化合物中只有离子键 |
| A. | 等物质的量的OH-与羟基(-OH)所含电子数相等 | |
| B. | 常温常压下,44 g CO2气体含有氧原子的个数为2 NA | |
| C. | 1 L 0.5 mol•L-1NaHCO3溶液中含有HCO3-的个数为0.5 NA | |
| D. | 11.2 g铁粉与稀硝酸反应转移电子数一定为0.6 NA |