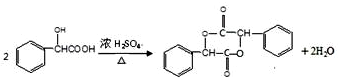
题目内容
5.研究含氮化合物具有重要意义.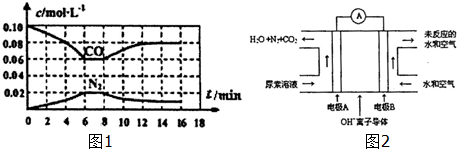
(1)反应2NO(g)+2CO(g)?N2(g)+2CO2(g),可用于消除汽车尾气中的有害气体.向恒容密闭容器中充入NO和CO的混合气体,部分物质的浓度变化如图1所示,则在4~6min时反应的平均速率v(N2)为0.005mol•L-1.第8min时改变的条件为升温,则该反应的△H<0(填“>”或“<”);
16min时改反应重新达到平衡的依据是ad(填字母)
a.单位时间内生成a mol CO2同时生成a mol CO
b.容器内NO与N2的物质的量之比为2:1
c.2v(CO)正=v(N2)逆
d.容器内的压强保持不变
e.容器内的气体密度保持不变
(2)一定温度下,在容积为1L的恒容密闭容器中充入2 mol N2O3,发生反应:
①N2O3(g)?N2O(g)+O2(g);
②N2O3(g)+O2(g)?N2O5(g),
平衡时,测得c(N2O5)为0.7mol•L-1,c(O2)为0.5 mol•L-1,则c(N20)=1.2mol•L-1,该温度下反应②的平衡常数为14mol•L-1.
(3)尿素燃料电池是一种新开发的环保电池,其工作原理如图2.OH+离子导体中OH-移动的方向为向左(填“向左”或“向右”),电极A是电池的负极,电极反应式为CO(NH2)2+6OH--6e-=CO2↑+N2↑+5H2O.
分析 (1)先计算CO的反应速率,再根据同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比计算v(N2);
升高温度CO的浓度增大,平衡逆向移动,升高温度平衡向吸热反应方向移动;
可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变,以及由此引起的一系列物理量不变;
(2)根据方程式知,c(N20)=c(O2)+c(N2O5)=0.5mol/L+0.7mol/L=1.2mol/L;
根据方程式知,剩余c(N2O3)=$\frac{2mol}{1L}$-1.2mol/L-0.7mol/L=0.1mol/L,
平衡常数K=$\frac{c({N}_{2}{O}_{5})}{c({N}_{2}{O}_{3}).c({O}_{2})}$;
(3)根据图知,该燃料电池中,通入氧化剂的电极B是正极,则A是负极,放电时,电解质溶液中阴离子向负极移动,负极上尿素失电子生成水、氮气和二氧化碳.
解答 解:(1)v(CO)=$\frac{0.08-0.06}{6-4}$mol/(L.min)=0.01mol/(L.min),再根据同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比得v(N2)=$\frac{1}{2}$v(CO)=$\frac{1}{2}$×0.01 mol/(L.min)=0.005mol/(L.min);
升高温度平衡向吸热反应方向移动,升高温度CO的浓度增大,平衡逆向移动,则正反应是放热反应,△H<0;
可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变,以及由此引起的一系列物理量不变,
a.单位时间内生成a mol CO2同时生成a mol CO,正逆反应速率相等,反应达到平衡状态,故正确;
b.容器内NO与N2的物质的量之比为2:1,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始物质的量和转化率有关,故错误;
c.当v(CO)正=2v(N2)逆,该反应达到平衡状态,则2v(CO)正=v(N2)逆没有达到平衡状态,故错误;
d.该反应的反应前后是气体体积减小的可逆反应,当容器内的压强保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
e.容器内气体质量、体积都不变,所以容器内的气体密度始终不变,不能据此判断平衡状态,故错误;
故选ad;
故答案为:0.005;<;ad;
(2)根据方程式知,c(N20)=c(O2)+c(N2O5)=0.5mol/L+0.7mol/L=1.2mol/L;
根据方程式知,剩余c(N2O3)=$\frac{2mol}{1L}$-1.2mol/L-0.7mol/L=0.1mol/L,
平衡常数K=$\frac{c({N}_{2}{O}_{5})}{c({N}_{2}{O}_{3}).c({O}_{2})}$=$\frac{0.7}{0.1×0.5}$L/mol=14L/mol,
故答案为:1.2;14;
(3)根据图知,该燃料电池中,通入氧化剂的电极B是正极,则A是负极,放电时,电解质溶液中阴离子向负极移动,所以氢氧根离子向左移动,负极上尿素失电子生成水、氮气和二氧化碳,电极反应式为CO(NH2)2+6OH--6e-=CO2↑+N2↑+5H2O,
故答案为:向左;负;CO(NH2)2+6OH--6e-=CO2↑+N2↑+5H2O.
点评 本题考查化学平衡计算、化学平衡状态判断、原电池原理等知识点,侧重考查基本计算、基本理论,注意(2)中第一步生成的氧气在第二步中发生反应,为易错点,难点是(3)题电极反应式的书写.

 对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )
对于CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O反应有关叙述正确的是( )| A. | 浓硫酸在该反应中起着降低反应活化能和提高原料转化率作用 | |
| B. | 该反应属于消去反应 | |
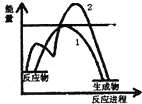
| C. | 如图表示放热反应的图象.曲线1表示未加催化剂, 则曲线2表示加了催化剂 | |
| D. | 该反应为放热反应,故升髙温度正反应速度减小,逆反应速度加快 |
| 选项 | 已知 | 解释与结论 |
| A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
| B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
| C | 常温下,Ksp(AgCl)=1.8×10-10、 Ksp(AgBr)=5.4×10-13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=3×10-3 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1molCO2通入750mL 2mol/LKOH溶液中:(K+)=2 c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 加入铝粉有气泡产生的溶液中存在离子:Na+、NH4+、Fe2+、NO3- | |
| C. | 等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应的离子方程式:CO32-+Ca2++H++OH-=CaCO3↓+H2O | |
| D. | Ca与O元素形成化合物中只有离子键 |
| A. | Na2S | B. | S | C. | S02 | D. | H2SO4 |
| A. | 电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移 | |
| B. | 含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 | |
| C. | 28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
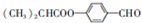 ,G的一种合成路线如下:
,G的一种合成路线如下: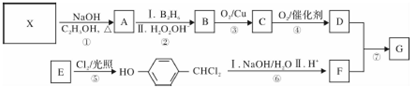
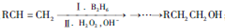 ;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.请回答下列问题:
;通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基.请回答下列问题: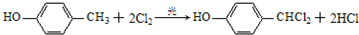 .
. .
.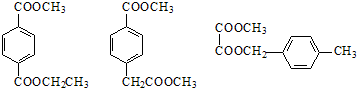 .
.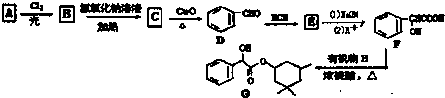
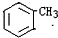 ,D→E的反应类型为加成反应
,D→E的反应类型为加成反应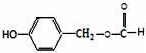
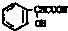 在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式
在一定条件下可以合成一种含三个六元环的有机物(C16H12O4),写出该反应的化学方程式