题目内容
1.化学与人们的日常生活密切相关,下列叙述正确的是( )| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
分析 A.根据水玻璃的性质分析;
B.油脂是小分子有机化合物;
C.甲醛有毒,不能用来保鲜食品;
D.棉、麻属于纤维素,羊毛属于蛋白质,合成纤维是以小分子的有机化合物为原料,经加聚反应或缩聚反应合成的线型有机高分子化合物,分子中出C、H元素外,还含有其它元素,如N元素等.
解答 解:A.水玻璃是硅酸钠的水溶液,硅酸钠具有黏性,所以可作粘合剂;涂有硅酸钠溶液的木条加热时,水分蒸发后不易燃烧,所以可作防火剂,故A正确;
B.纤维素是天然有机高分子化合物,油脂不是高分子化合物,故B错误;
C.甲醛有毒,能破坏蛋白质的结构,对人体有害,不能用来保鲜食品,故C错误;
D.棉、麻属于纤维素,含有C、H两种元素,完全燃烧只生成CO2和H2O;羊毛属于蛋白质,含有C、H、O、N等元素,完全燃烧除生成CO2和H2O,还有其它物质生成;合成纤维是以小分子的有机化合物为原料,经加聚反应或缩聚反应合成的线型有机高分子化合物,分子中出C、H元素外,还含有其它元素,如N元素等,完全燃烧除生成CO2和H2O,还有其它物质生成,故D错误;
故选:A.
点评 本题考查了生活中常见物质的用途,熟悉硅酸钠、甲醛、合成纤维的性质是解题关键,注意高分子化合物的判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.电解NO 制备NH4NO3,其工作原理如图所示.下列说法中正确的是( )
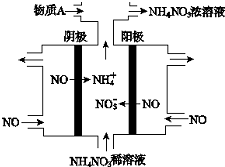

| A. | 阳极上的电极反应为:NO•3e-+4OH-=NO3-+2H2O | |
| B. | 电解生成1 mol NH4NO3 时,转移5NA电子 | |
| C. | 电解质溶液中,NO3-离子向阴极移动 | |
| D. | 为了使电解产物全部转化为NH4NO3,需补充的物质A为稀硝酸 |
9.某试液中只可能含有K+、NH4+、Fe2+、Fe3+、Cl-、SO42-、NO3-、AlO2- 中的若干种离子,离子浓度均为0.1mol•L-1,某同学进行了如图实验:
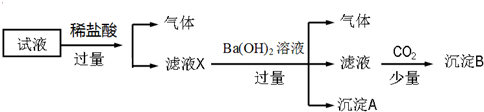
下列说法正确的是( )

下列说法正确的是( )
| A. | 无法确定原试液中是否含有Fe3+、K+ | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ | |
| C. | 无法确定沉淀B的成分 | |
| D. | 原溶液中一定存在的离子为NH4+、Fe2+、NO3-、SO42- |
6. 下列说法正确的是( )
下列说法正确的是( )
①实验室能用酒精灯加热的有蒸发皿、圆底烧瓶、烧杯
②若蒸馏100ml石油可将其置于250ml蒸馏烧瓶中
③新制的氯水保存在棕色广口瓶中,并放在阴凉处
④波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中
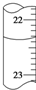
⑤若滴定管中的液面如图所示,则其读数应为23.65mL.
 下列说法正确的是( )
下列说法正确的是( )①实验室能用酒精灯加热的有蒸发皿、圆底烧瓶、烧杯
②若蒸馏100ml石油可将其置于250ml蒸馏烧瓶中
③新制的氯水保存在棕色广口瓶中,并放在阴凉处
④波尔多液(CuSO4与石灰水按一定比例混合)盛放在铁制容器中
⑤若滴定管中的液面如图所示,则其读数应为23.65mL.
| A. | ①② | B. | ①③④ | C. | ③④⑤ | D. | ②③⑤ |
13.下列有关叙述不正确的是( )
| 选项 | 已知 | 解释与结论 |
| A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
| B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
| C | 常温下,Ksp(AgCl)=1.8×10-10、 Ksp(AgBr)=5.4×10-13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=3×10-3 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
10.下列各项叙述与结果正确的是( )
| A. | 1molCO2通入750mL 2mol/LKOH溶液中:(K+)=2 c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 加入铝粉有气泡产生的溶液中存在离子:Na+、NH4+、Fe2+、NO3- | |
| C. | 等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应的离子方程式:CO32-+Ca2++H++OH-=CaCO3↓+H2O | |
| D. | Ca与O元素形成化合物中只有离子键 |
11.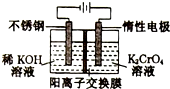 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )| A. | 在阳极室,通电后溶液逐渐由橙色变为黄色 | |
| B. | 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g | |
| C. | 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d |


